Frequentemente ocorrem descobertas simultâneas na ciência, e estas têm maior probabilidade de êxito quando dados suficientes e de boa qualidade são coletados; o que tende a despertar a imaginação dos cientistas.
Em 1860, o Congresso de Karlsauhe reuniu muitos químicos de grande importância na época com a intenção de obter concordâncias em alguns resultados e ideias, tais como a existência do átomo, suas massas atômicas corretas e a maneira pela qual os elementos se relacionam entre si. A nenhum resultado satisfatório se chegou, mas algumas ideias foram defendidas de maneira excessivamente enérgica. “Um dos conceitos discutidos foi o Princípio de Avogadro – de que o número de moléculas de diferentes gases, em amostras de iguais volumes, pressão e temperatura, é o mesmo”1. Foi esse princípio que levou à determinação correta para as massas atômicas dos elementos químicos. Mas o fato mais importante foi realmente o comparecimento nesse congresso de Mendeleev e Meyer; ambos levaram consigo os trabalhos de Avogadro.
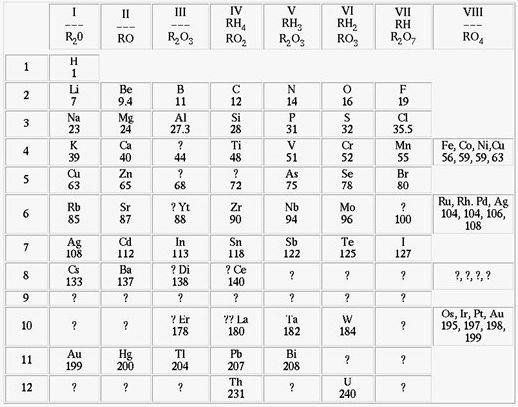
“Em 1869, Mendeleev e Meyer descobriram independentemente que um padrão regular de repetição das propriedades podia ser observado quando os elementos eram arranjados em ordem crescente de massas atômicas. Mendeleev chamou esta observação de lei periódica”, e esboçou seu trabalho que iniciou conforme o apresentado na figura abaixo.
Trabalhando independentemente, Mendeleev e Meyer descobriram a lei periódica e publicaram o que ficou conhecido como Tabela Periódica dos Elementos Químicos. “Meyer publicou primeiro em 1864, e em 1869 expandiu sua tabela para mais de 50 elementos. Ele demonstrou a variação de propriedades periódicas, como o volume molar, o ponto de ebulição e a dureza, como uma função da massa atômica”3. No mesmo ano, Mendeleev publicou uma versão mais completa e sofisticada que Meyer, mostrada abaixo.
Conforme pôde ser visto, a audaciosa, mas coerente, visão química do gênio russo o levou a deixar espaços vazios em sua tabela que posteriormente seriam ocupados por elementos químicos ainda não conhecidos na época. Quando estes foram descobertos, evidenciou-se restrita exatidão nas previsões de Mendeleev. Por exemplo, “...seu padrão requeria um elemento chamado por ele de “eka-silício”, abaixo do silício e acima do estanho. Ele previu que o elemento deveria ter massa atômica relativa de 72 (tomando a massa do hidrogênio como 1) e propriedades similares àquelas do silício. Esta predição impulsionou o químico alemão Clemen Winkler, em 1886, a descobrir o eka-silício, que ele chamou de germânio” 1.
Referências:
1. ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
2. PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
3. RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/classificacao-periodica-de-mendeleev/