O fenômeno da eletricidade é algo comum, embora nem sempre fora assim. Na Grécia antiga os fenômenos elétricos atmosféricos, como raios e relâmpagos, eram atribuídos a Zeus. Foi com o advento da produção de pilhas e baterias, como a pilha de Alessandro Volta, que se tornou possível a domesticação deste titã da natureza, surgindo uma nova ramificação da química: a eletroquímica.
É nesta nova área que se insere o termo denominado eletrólise, nome dado ao processo que utiliza energia elétrica para realizar uma transformação que, de maneira autônoma, não se processaria sozinha.
Cabe ressaltar que em muitos casos, a transformação que as substâncias sofrem não é espontânea, demandando quantidades significativas de energia elétrica. É o caso da transformação do minério bauxita (Al2O3 • x H2O) em alumínio, que ocorre a altas temperaturas e com um alto consumo de energia elétrica.
Atualmente existem dois tipos de processo eletrolítico: a eletrólise ígnea e a eletrólise em solução aquosa.
Eletrólise ígnea
É denominada eletrólise ígnea o processo eletrolítico que necessita da fundição do material a sofrer a transformação. Esta fundição se faz necessária, pois assim ocorrerá a mobilidade dos íons que se deseja obter separados, possibilitando a passagem da corrente elétrica pelo meio reacional. O exemplo do alumínio, no parágrafo anterior, ocorre somente em cubas eletrolíticas adequadas à eletrólise ígnea. Metais das famílias I e II da tabela periódica, como por exemplo sódio e magnésio, também são produzidos por eletrólise ígnea de seus sais ou óxidos correspondentes.
Eletrólise em solução aquosa
Já na eletrólise em solução aquosa o processo se dá com a livre circulação dos íons em meio aquoso, sendo estes íons na esmagadora maioria dos caos, provenientes de sais iônicos. Diferente da eletrólise ígnea, a eletrólise em solução aquosa não necessita de altas temperaturas e nem de compartimentos extremamente refinados de isolamento entre os seus produtos, pois os materiais separados geralmente não interagem agressivamente. A eletrólise da salmoura (solução aquosa de cloreto de sódio) é exemplo disso e produz hidróxido de sódio e cloro gasoso, dois insumos industriais de extrema importância.
Há, no entanto, uma limitação na eletrólise aquosa: a prioridade de descarga dos íons em solução. Como os íons se encontram dissolvidos em água e a própria água se ioniza, existirão momentos em que os íons irão “competir” pela possibilidade de serem oxidados ou reduzidos. Ou seja, os cátions e ânions à esquerda da água não serão formados na eletrólise aquosa, como demonstra a figura abaixo.
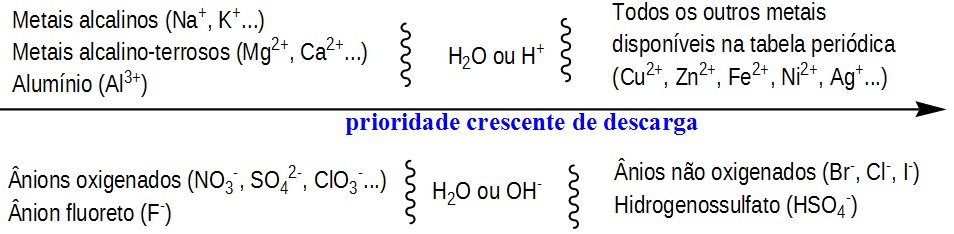
Prioridade de descarga de cátions e ânions.
A prioridade de descarga orienta um setor inteiro da indústria, representado pela galvanoplastia de objetos metálicos. Através da utilização dos preceitos da eletrólise em solução aquosa, um ramo importante da indústria combate a corrosão metálica.
A galvanoplastia, utilizada para proteger metais da corrosão, emprega uma camada metálica (eletroliticamente construída) sobre o metal que se deseja proteger. Estes metais geralmente reagem com as intempéries do ambiente (chuva, sol, oxigênio do ar, etc.), e esta reatividade demanda proteção. É através da galvanoplastia que obtemos objetos “cromados”, “niquelados” ou “banhados a ouro”, que atendem não somente à demanda por proteção do metal como também a apelos estéticos ditados pela sociedade e é através deste processo que se obtém cobre eletroliticamente puro (99,9% de pureza).
Referências:
LISBOA, J. C. F. Química, 2º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 292 – 353.
FELTRE, R. Físico – Química – 5ª Ed. – São Paulo: Moderna, 2000. p.361 – 443.
Texto originalmente publicado em https://www.infoescola.com/quimica/eletrolise/