O hidróxido de sódio, cuja fórmula molecular é o NaOH, pertence a classe das bases, sendo classificada como forte, e é também comumente chamado de soda cáustica. É um sólido (temperatura ambiente) branco cristalino, higroscópico (absorve água),é bastante solúvel em água e se ficar exposto ao ambiente por algum tempo, absorve a umidade do ar e vai se tornando um liquido incolor. Tem uma massa específica (densidade) de 2,3 g/ cm3, ponto de fusão de 318 °C (anidro), sendo solúvel em água e solventes polares e forma uma solução corrosiva. É considerada uma substância química muito perigosa por ser tóxica e reagir exotermicamente (liberando calor) com água, ácido e solventes polares, liberando vapor sufocante e corrosivo e formando soluções fortemente alcalinas. Seja na forma sólida ou em solução pode causar sérias queimaduras quando em contato com pele ou olhos.
O NaOH não existe na natureza, ele é preparado industrialmente pela eletrólise de um solução aquosa de cloreto de sódio (NaCl). No processo são utilizados eletrodos inertes, sendo produzidos gás cloro (Cl2) no eletrodo positivo e gás hidrogênio (H2) no eletrodo negativo.
2NaCl(aq) + 2H2O(l) → 2 NaOH(aq) + Cl2(g) + H2(g)
É um composto reativo, e reage com ácidos (orgânicos e inorgânicos) formando sal e água.
2 NaOH(aq) + H2SO4(aq) → Na2SO4(s) + 2 H2O(l)
CH3COOH(l) + NaOH(aq) → CH3COONa(s) + H2O(l)
Reage de forma violenta com metal alumínio, formando gás hidrogênio.
2Al(s) + 2NaOH(aq) + 2H2O(l) → 2NaAlO2(s) + 3 H2(g)
Reage com óxidos ácidos produzindo sal e água.
SiO2(s) + 2 NaOH(aq) → Na2(SiO3)(s) + H2O(l)
O SiO2 está presente na composição do vidro, por isso NaOH deve ser armazenado em frascos plásticos.
É vendido para uso doméstico, pois reage com a gordura e ajuda no desentupimento de encanamentos e limpezas mais pesadas. Porém é preciso utilizar luvas e tomar cuidado na utilização em função das suas propriedades alcalinas que corrosivas que podem causar queimaduras graves.
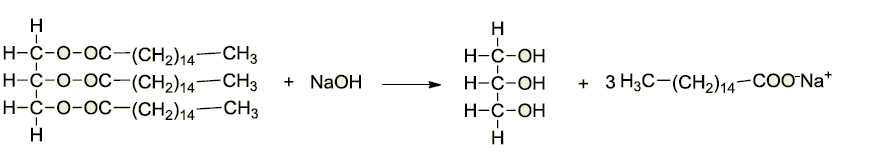
Uma de suas reações mais famosas, que vem sendo feita desde a antiguidade e é feita inclusive em casa, é na produção de sabões, que tem como subproduto os gliceróis, utilizando gordura utilizada. Essa reação é conhecida como saponificação, onde o NaOH reage com um éster, produzindo o sabão e glicerol. No exemplo abaixo temos o tripalmitil-glicerol reagindo para formar o glicerol e palmitato de sódio (sabão).
Outra reação bastante importante é a de produção do ácido salicílico, a partir do fenol em meio básico (NaOH), em seguida o fenolato de sódio reagem com CO2 para formar salicilato de sódio, que em meio ácido se converte em ácido salicílico. Esse ácido é utilizado na produção de ácido acetilsalicílico, conhecido como AS.
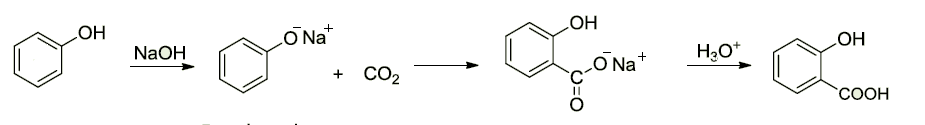
Obtenção de ácido salicílico
O NaOH tem uma vasta aplicação, sendo utilizado na fabricação de papel, celulose, alumina, síntese de biodiesel, analises diversas em laboratórios de ensino e pesquisa, purificação de óleos vegetais, refino do petróleo e seus derivados, metalurgia. Também tem aplicação no tratamento de água, regeneração de resinas de troca iônica, neutralização de efluentes, fabricação de vidros, produtos para alisar cabelos, entre outros usos.
Referencias
Atkins, P. W.; Jones, Loretta . Princípios de química: questionando a vida moderna e o meio ambiente. Volume único. 3. ed. Porto Alegre: Bookman, 2006.
da Silva, I. M. C. B. Métodos de Preparação Industrial de Solventes e Reagentes Químicos. Revista Virtual Química. Vol 4 No.1 73-82.
https://cetesb.sp.gov.br/laboratorios/wp-content/uploads/sites/24/2013/11/Hidroxido-de-Sodio.pdf
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte A Química Geral. Editora Saraiva 2005.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/soda-caustica/