Ao contrário das reações endotérmicas, as reações exotérmicas possuem um balanço negativo de energia quando se compara a entalpia total dos reagentes com a dos produtos. Assim, a variação entálpica final é negativa (produtos menos energéticos do que os reagentes) e indica que houve mais liberação de energia, na forma de calor, para o meio externo que absorção – também sob forma de calor.
Portanto, a temperatura final dos produtos é maior que a temperatura inicial dos reagentes.
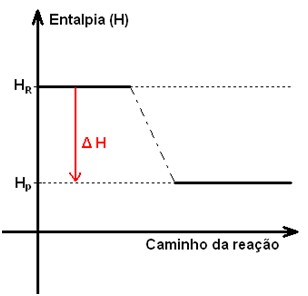
O esquema de uma reação exotérmica é representado no gráfico a seguir:
De acordo com a imagem, pode-se perceber que os reagentes encontram-se num patamar energético mais alto que os produtos. Dessa forma, para que sejam produzidos, os reagentes liberam parte da energia contida sob forma de calor. Sendo que se fornecêssemos calor ao recipiente no qual os compostos estão contidos, deslocaríamos o equilíbrio da reação para o lado dos reagentes. Ou seja, dificultaríamos a formação dos produtos.
Em contraste, numa reação endotérmica, o fornecimento de energia desloca o equilíbrio para a formação de produtos. Uma vez que este processo absorve calor do meio.
Portanto, HR + Energia cedida ao meio = HP. Ou ainda, Energia cedida ao meio = HP - HR. E, sendo a energia cedida ao meio a variação de entalpia ΔH, com HP< HR: ΔH<0 (negativo).
Exemplos de Reações Exotérmicas
½ O2(g) + H2(g) -> H2O(l) (ΔH = -68,3 Kcal/mol ou -285,49 KJ/mol)
½ H2(g) + ½ Cl2(g) -> HCl(g) (ΔH = -22,0 Kcal/mol ou -91,96 KJ/mol)
½ H2(g) + ½ Br2(g) -> HBr(g) (ΔH = -8,6 Kcal/mol ou -35,95 KJ/mol)
C(s) + ½ O2(g) -> CO(g) (ΔH = -26,4 Kcal/mol ou -110,35 KJ/mol)
C(s) + O2(g) -> CO2(g) (ΔH = -94,1 Kcal/mol ou -393,34 KJ/mol)
S(s) + O2(g) -> SO2(g) (ΔH = -70,9 Kcal/mol ou -296,36 KJ/mol)
Observe que toda e qualquer reação de combustão é estritamente exotérmica.
Espontaneidade das Reações
Por muito tempo achava-se que as reações exotérmicas eram sempre espontâneas, ao ponto que as endotérmicas eram completamente o oposto. Entretanto, a Química Moderna afirma que não se pode tomar esse preceito como uma regra geral: há reações endotérmicas espontâneas (como a reação entre amônia e água formando a base fraca hidróxido de amônio – NH4OH); assim como há reações exotérmicas que não ocorreriam se uma fonte de ignição não fosse adicionada (como a reação entre hidrogênio e oxigênio gasosos formando água).
Para prever a espontaneidade das reações de um modo mais eficiente, deve-se utilizar a relação da energia livre de Gibbs: onde, uma reação será certamente espontânea se tende a diminuir a entalpia, aumentar a entropia do sistema e, conseqüentemente, diminuir a capacidade de realizar trabalho (ΔG<0). Sendo, então, não espontânea se tende a aumentar a entalpia, diminuir a entropia do sistema e aumentar a capacidade de realizar trabalho (ΔG>0).
A equação da variação da energia livre de Gibbs é a seguinte:
ΔG = ΔH – T. ΔS
Onde, ΔH = variação de entalpia total da reação (em KJ/mol)
T = temperatura absoluta do sistema (em K)
ΔS = Variação de entropia (em KJ/mol.K)
Referência:
http://netopedia.tripod.com/quimic/termoquimica.htm (acesso em 13/08/2010)
Texto originalmente publicado em https://www.infoescola.com/quimica/reacoes-exotermicas/