A cinética química estuda a velocidade que as reações ocorrem e os fatores que podem alterá-la. Um dos fatores envolvidos no processo reacional é a energia de ativação.
Primeiro devemos entender a teoria que rege o estudo da cinética. Em um sistema os reagentes tendem a colidir para formar produtos. No entanto esta colisão, ou choque, deve ser efetiva para que gere a energia necessária para iniciar a reação. A quantidade de energia necessária para que uma reação ocorra se chama energia de ativação e pode ser observada no gráfico abaixo:
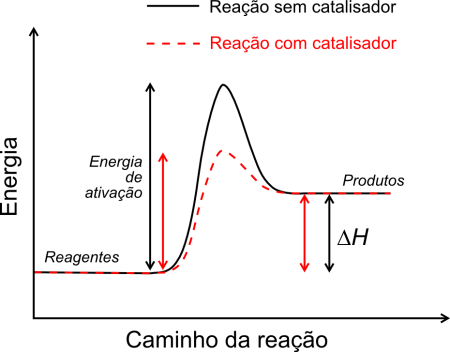
Energia de ativação. Ilustração: Bkell / Wikimedia Commons
No gráfico percebemos que a energia de ativação é o caminho dos reagentes até o ponto mais energético (mais alto) do gráfico que é o complexo ativado, momento reacional onde reagentes e produtos coexistem. Após isso está representada a formação dos produtos. Devemos entender que quanto maior for o caminho dos reagentes até a formação do complexo ativado (a energia de ativação) mais tempo a reação leva para ocorrer.
Temos alguns fatores que podem influenciar a velocidade de uma reação conforme já citamos e são eles: a temperatura, a pressão, a concentração, a superfície de contato e por fim, o catalisador e o inibidor.
Os catalisadores são muito utilizados na indústria principalmente porque eles têm por função acelerar a reação sem alterar a formação, ou a quantidade formada de produtos. Quando se utiliza o catalisador a reação tem seu caminho reacional diminuído, ou seja, diminui a energia de ativação (linha vermelha no gráfico), fazendo com que a reação se torne mais rápida. Quando se utiliza o inibidor ocorre o contrário, o caminho reacional aumenta e a reação torna-se mais lenta.
Nas reações endotérmicas, que são aquelas que absorvem energia a energia de ativação é maior do que nas reações exotérmicas que são aquelas que liberam energia.
Fonte:
BALL. D. Físico-Química. Vol2.
Texto originalmente publicado em https://www.infoescola.com/quimica/energia-de-ativacao/