Poucas substâncias encontradas na natureza são puras, a maioria delas é formada por mais de uma substância, conhecidas como misturas. As misturas constituídas de duas ou mais substâncias e que apresentam aspecto uniforme são chamadas de soluções. O ar que envolve Terra é um exemplo de solução gasosa formada por gases como O2 e N2, a água dos oceanos é uma solução líquida de vários sais dissolvidos, as ligas metálicas são soluções sólidas, por exemplo, o aço.
Para que uma solução seja formada, é preciso haver dois componentes: o solvente, aquele que dissolve, e o soluto, aquele que é dissolvido. O solvente é encontrado sempre em maiores proporções do que o soluto e existe também, uma determinada quantidade de soluto que o solvente consegue dissolver, quantidade esta denominada Coeficiente de solubilidade.
Vamos tomar como exemplo uma solução de água (tida como solvente universal) e NaCl (o sal de cozinha). A quantidade máxima de NaCl capaz de ser dissolvida em 100 g de H2O a 20°C é 36 g. Uma solução nessas condições é denominada solução saturada, logo, o coeficiente de solubilidade desse sal é de 36 g de NaCl/ 100 g de água a 20°C. Mas nem sempre o sistema apresenta uma quantidade máxima de soluto, sendo assim, uma solução com quantidade de soluto inferior ao coeficiente de solubilidade é chamada de solução insaturada.
Porém, se um sistema constituído de 100 ml de água e 50 g de NaCl for submetido ao aquecimento e sob agitação, é possível dissolver o sal completamente. Quando esse sistema esfria, em repouso absoluto, até a temperatura inicial (20°C), será formada uma solução que contém maior quantidade de soluto (50 g) do que a respectiva solução saturada (36 g). Essa solução é conhecida como supersaturada e é muito instável. Agitando-a ou adicionando a ela um pequeno cristal de soluto, haverá a precipitação de 14 g do sal, que é exatamente a quantidade excedente de soluto em relação ao coeficiente de solubilidade e, portanto, não pode ser dissolvida. Essa precipitação também é denominada corpo de fundo.
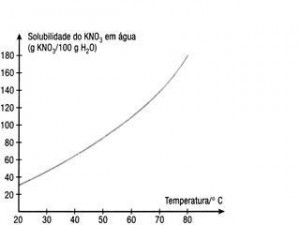
É possível compreender, então, que a quantidade de soluto passível de ser dissolvida pelo solvente é proporcional à temperatura. Essa razão pode ser mais bem expressa em gráficos denominados curvas de solubilidade. Observe:
No gráfico acima, temos a curva de solubilidade do nitrato de potássio (KNO3) em 100 g de água. Veja que o aumento da temperatura ocasiona o aumento da solubilidade desse composto em água, formando soluções supersaturadas.
Referências
MOORE, Walter J. Traduzido por: JORDAN, Ivo. Físico-química. Edgard Blucher: São Paulo, 1976. 4ª edição.
PILLA, Luiz. Físico-química. Livros Técnicos e Científicos Editora S.A.: Rio de Janeiro: 1979. 1ª edição.
Texto originalmente publicado em https://www.infoescola.com/quimica/saturacao-de-solucoes/