Analisando-se os fenômenos naturais, a humanidade propôs uma série de regras e leis visando à domesticação da natureza. Deste esforço surgiram teorias científicas e postulados teóricos sobre basicamente todo o Universo. Em termos absolutos, a proposição de um modelo de explicação não é garantia de infalibilidade do mesmo, ou seja, conforme a sociedade evolui, novos fenômenos demandam novas interpretações de velhos postulados teóricos.
O modelo atômico de John Dalton (1766 - 1844) foi proposto no início do século XIX, abordando concepções acerca da matéria e do átomo. A ideia de átomo já estava em construção antes de Dalton, em parte pela concepção de matéria contínua (sem divisões, sem átomos) não explicar os fenômenos estudados à época. O modelo também ficou conhecido como bola de bilhar.
Para Dalton, a matéria era descontínua, ou seja, entre os átomos que a compõe existiriam espaços vazios. Embora seja considerado o teórico por detrás da proposição deste modelo, Dalton considerou informações relevantes de outros estudos (Leis ponderais de Proust; Lavoisier e a concepção de elemento; gases e suas leis etc.), o que permitia a seu modelo explicar os fenômenos até então discutidos. É este o “trunfo” de seu modelo atômico, pois embora apresente claras restrições à Ciência da atualidade, para seus contemporâneos, este modelo satisfazia muitos comportamentos que a matéria contínua era incapaz de sequer prever.
As ideias de Dalton eram consideradas adequadas devido a seu esforço em atrelar os postulados teóricos a dados obtidos de maneira científica, através da experimentação. Tal fato corroborou na aceitação de seu modelo pelos cientistas da época, fazendo com que Dalton entrasse para a história da química e da humanidade.
Abaixo encontram-se sintetizadas todas as ideias de Dalton acerca da matéria, átomo e por consequência, de seu modelo atômico.
- Toda matéria é formada por átomos esféricos (maciços, indivisíveis e indestrutíveis).
- Cada elemento apresentará um tipo de átomo.
- Átomos de um mesmo elemento são iguais.
- Átomos de elementos diferentes possuem massas diferentes.
- Substâncias compostas, formadas por elementos diferentes, apresentam proporção fixa de átomos.
- Nas reações químicas não há destruição de átomos, e sim rearranjo dos mesmos, formando novas substâncias.
Dalton também construiu uma simbologia, na tentativa de catalogar elementos e as reações químicas advindas dos mesmos. Embora este aspecto de seu modelo atômico não tenha encontrado muitas aplicações práticas, não é demérita sua proposição. A figura a seguir traz alguns dos elementos químicos, sugeridos por Dalton.
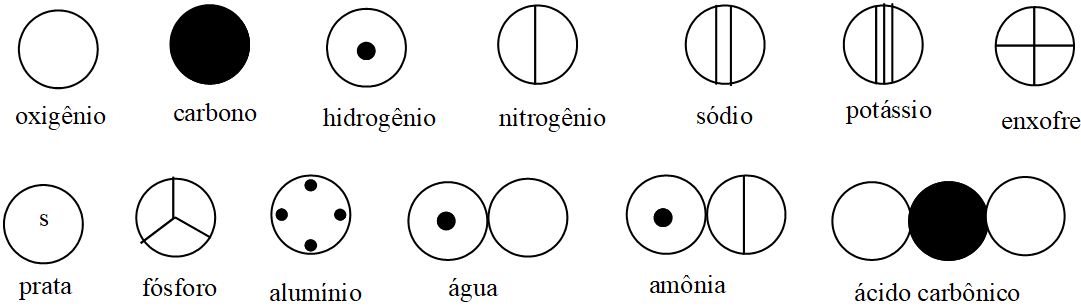
Como a tecnologia da época não permitia a distinção, alguns compostos acabaram sendo classificados por Dalton como elementos. É o caso do alumina (Al2O3), que na figura acima é representada como alumínio. Outro ponto interessante, como a quantidade representada de elementos e compostos: a água (H2O) de Dalton apresenta apenas um hidrogênio e um oxigênio, o que é, ao menos simbologicamente analisando, equivocado.
Como o modelo atômico de Dalton não previa a existência de subdivisões atômicas (prótons e elétrons, por exemplo), tal modelo não conseguiu explicar fenômenos como a condução elétrica de metais e soluções salinas, nem tampouco a própria eletrólise, porém, o modelo de Thomson, que sucedeu ao de Dalton, não invalidou totalmente as ideias de Dalton. Thomson “atualizou” as ideias de Dalton, inserindo suas próprias observações no processo e criando um modelo que explicava mais fenômenos que o anterior.
Referências:
LISBOA, J. C. F. Química,1º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 117 – 121.
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 121 – 123.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.55 – 56.
Texto originalmente publicado em https://www.infoescola.com/quimica/modelo-atomico-de-dalton/