Estudos sobre a natureza elétrica da matéria do final do século XIX iniciaram uma lenta mudança na concepção de átomo. Uma vez que o modelo de Dalton não previa nenhum tipo de atividade elétrica, cientistas que desenvolviam trabalhos com a eletricidade começaram a questionar-se a respeito da validade deste modelo.
Em 1903, Joseph John Thomson (1856-1940) propôs uma explicação satisfatória ao fenômeno elétrico da matéria. Em seus estudos, Thomson adaptou a ampola de Crookes (ampola de raios catódicos), visando testar a natureza elétrica destes raios. Detectou então que as partículas que eram geradas no cátodo (daí o nome raio catódico) eram desviadas pelo eletrodo positivo e independiam das outras variáveis do experimento (gás que preenchia a ampola; o metal que compunha o cátodo ou o ânodo; o metal que compunha os eletrodos).
Thomson então determinou o desvio que o raio catódico sofrera pelo campo magnético positivo do eletrodo, chegando à conclusão de que os raios catódicos eram formados por feixes de partículas idênticas, de carga negativa, de massa extremamente pequena e de menor carga elétrica. Conforme citado no parágrafo anterior, devido à característica do raio catódico ser desviado independentemente das condições, Thomson afirmou ser esta partícula negativa inerente a todos os átomos e denominou-a elétron.
Este é um resumo das bases teóricas que permitiram a Thomson propor o seu modelo atômico. Utilizando-se de preceitos do modelo de Dalton (massas dos átomos), Thomson incluiu o resultado teórico de suas observações ao modelo vigente, sugerindo assim a explicação que ficou conhecida o modelo atômico de Thomson.
Thomson admitia que o átomo fosse composto por cargas positivas e negativas (ambas foram detectadas em suas pesquisas). Segundo seu postulado, a esfera maciça possuiria carga positiva. A carga negativa seria representada por incrustações nesta esfera positiva. Na imagem a seguir temos uma possível representação do modelo de Thomson, que ficara conhecido também como modelo “pudim de passas”.
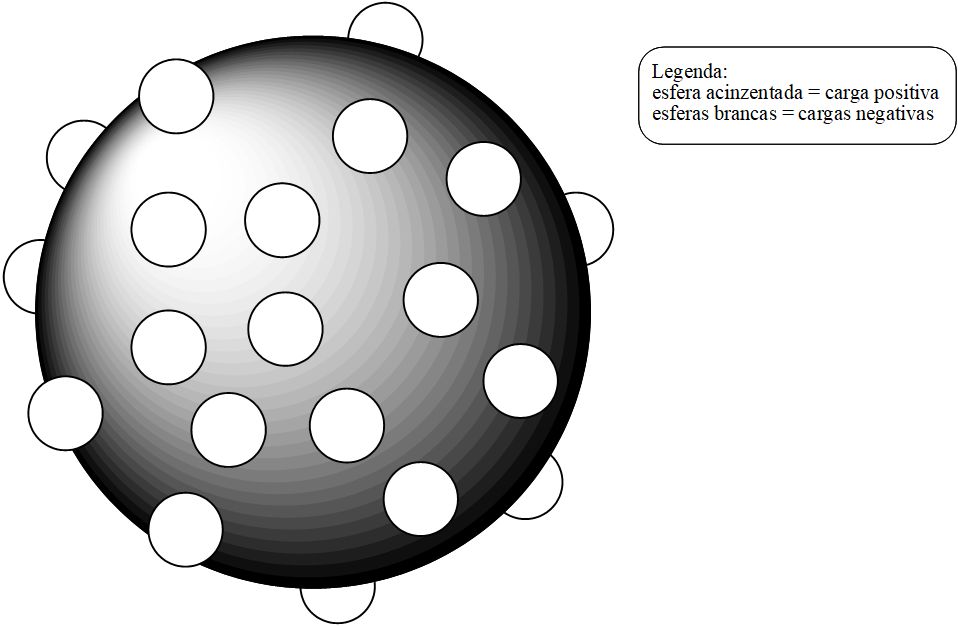
Representação sem escala e em cores fantasia do modelo atômico de Thomson.
A possibilidade de explicar o comportamento elétrico das substâncias químicas, como a formação de compostos iônicos quando se solubilizam sais e a condutibilidade proveniente desta dissolução. O comportamento de metais frente à condução elétrica também é exemplo de como este modelo explica condições na natureza, que o modelo de Dalton não era capaz de explicar.
Para Thomson, os elétrons incrustados na esfera positiva (próton) deveriam estar em quantidade suficiente para anular as cargas positivas, tornando-se um corpo eletricamente neutro. A formação dos íons se daria pelo desequilíbrio nesta relação, onde o papel dos elétrons dispersos na esfera positiva seria vital: seriam eles que sofreriam aumento ou diminuição em seus números. Logo, para que um átomo apresentasse comportamento iônico, ela deveria apresentar excesso ou falta de cargas negativas.
Átomos que perdessem um elétron ficariam positivamente carregados, justamente por existir uma carga positiva a mais em relação ao número de elétrons (prótons > elétrons), tornando-se um íon positivo ou cátion. O contrário também aconteceria, segundo Thomson, pois possuindo um elétron a mais o átomo terminaria por carregar-se negativamente (próton < elétron), tornando-se um íon negativo ou ânion.
Com o advento da radioatividade, cientistas questionaram características do modelo atômico de Thomson frente a novos fenômenos, e a ciência dos modelos atômicos deu mais um avanço na história, com o modelo de Rutherford.
Referências:
LISBOA, J. C. F. Química, 1º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 113 – 115.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.84 – 87.
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 25 – 34.
Texto originalmente publicado em https://www.infoescola.com/quimica/modelo-atomico-de-thomson/