O selênio é um elemento químico pertencente ao grupo ou família 6A da classificação periódica ou família dos calcogênios, possui número atômico 34, massa atômica 78,96 g mol-1, ponto de fusão 220°C e ponto de ebulição de 685°C. A coloração do elemento esta diretamente relacionada com suas formas alotrópicas, sendo a mais estável, a cristalina hexagonal que apresenta uma cor cinza metalizada, a forma monoclínica apresenta cor vermelha e o selênio amorfo tem coloração vermelha escura tendendo ao preto.
Foi descoberto por J.J. Berzélius no ano de 1817, movido pela afirmação de Martin Klaprot, de que a coloração residual, de um subproduto da fabricação do ácido sulfúrico tratava-se de telúrio, porém Berzélius não satisfeito com as afirmações submeteu à amostra a análise concluindo que, o resíduo se tratava de um novo elemento químico. Estava descoberto o selênio, que recebeu esse nome em virtude de ter sido confundido com o telúrio originado do latim “Tellus” que significa deusa terra, Berzélius decidiu que o novo elemento por ele descoberto chamar-se-ia Selênio proveniente do grego “Selene”, que significa deusa Lua.
O selênio é elemento que apresenta características muito parecidas com as do enxofre e telúrio, em seus compostos forma selenetos, selenitos e selenatos, e também o gás hidreto de selênio SeH2(veneno), visto que a boa parte dos compostos de selênio apresentam características tóxicas.
É obtido como subproduto a partir de resíduos da purificação eletrolítica de metais nobres em âmbito industrial e também é encontrado na castanha-do-pará que é uma das fontes do elemento para os seres vivos. O selênio nas quantidades adequadas faz parte da nutrição humana e encontramos em carnes e vegetais principalmente.
O elemento é utilizado no processo de fabricação do vidro, tintas como conferente de cor vermelha, no vidro comumente como descorante, em sua forma metálica na fabricação de células fotovoltaicas devido a sua propriedade de transformar energia luminosa em energia elétrica e como catalisador em reações químicas.
O selênio Quimicamente
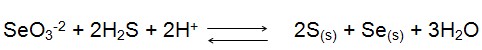
Este elemento reage com HNO3 concentrado e água-régia, formando o ácido selenioso H2SeO3. Para as reações químicas em escala analítica os íons mais interessantes são os selenitos SeO3-2 e selenatos SeO4-2. Possui o número de oxidação -2, +2,+4 e +6, em virtude de sua configuração eletrônica 1s², 2s², 2p6, 3s², 3p6, 4s², 3d10, 4p4. Podemos facilmente obter o selênio de seus compostos através da reação com o sulfeto de hidrogênio, visto que, desta também obtem-se o enxofre de acordo com a seguinte reação:
Selênio em Bioquímica
É importante frisar que o selênio apesar de tóxico desempenha um papel fundamental para manutenção das diversas formas de vida existentes, sendo indispensável em razão de formar uma classe de importantes proteínas, chamadas de selenoproteínas, algumas abaixo citadas por serem as mais importantes e responsáveis pelos processos metabólicos do organismo de seres vivos:
- Selenoproteína P
- Selenoproteína W
- Selenofosfato sintetase
Bibliografia:
Russel, J. B. Química geral. São Paulo: Makron Books, 2004.
Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : MestreJou, 1981 .
Mahan, B. M. Química: um curso universitário. 4a ed. São Paulo: Edgard Blücher, 2003.
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica - 4ª edição. Porto Alegre, Bookman, 2008.
LEE, J.D.. Química inorgânica não tão concisa – tradução da 4ª edição inglesa. São Paulo, Edgard Blücher, 1996.
LEHNINGER, A. L. Princípios de Bioquímica. São Paulo: Savier, 1985. p. 194, 195 e 553.
http://www.chemicool.com/
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/selenio/