A quantidade de calor necessária para provocar a mudança de estado físico de um corpo, à temperatura constante, é denominada calor latente. Quando a mudança de estado físico é da fase sólida para a líquida, e vice-versa, é denominado calor latente de fusão. Quando é da fase líquida para a gasosa, e vice-versa, é denominado calor latente de vaporização.
Observamos que o calor latente de fusão e de solidificação é o mesmo em uma substância, visto que é a mesma quantidade calor requerida para se fundir ou se solidificar. Da mesma forma, o calor latente de vaporização e de liquefação são os mesmos também para uma dada substância.
Sendo assim, seja um corpo de massa m que recebe uma quantidade de calor Q, de forma que haja uma mudança em seu estado físico, sem variação de temperatura. Foi verificado experimentalmente que a quantidade de calor Q recebida é proporcional a massa m do corpo, ou seja,
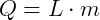
L é o coeficiente de proporcionalidade, independente da massa e característico de cada substância, dado por cal/g. Este coeficiente L é denominado calor latente.
Para a água temos os seguintes valores de calor latente:
| calor latente | cal/g |
| de fusão | LF = 80 |
| de solidificação | LS = -80 |
| de vaporização | LV = 540 |
| de liquefação | LL = -540 |
As substâncias puras, no processo de mudança de estado físico, obedecem as seguintes leis, determinadas experimentalmente:
- 1ª Lei: Se durante toda a mudança de estado a pressão for mantida constante, a temperatura também permanecerá constante;
- 2ª Lei: Cada substância, a uma dada pressão, tem a sua temperatura (ponto) de fusão ou solidificação e a sua temperatura (ponto) de ebulição ou liquefação;
- 3ª Lei: Ao variar a pressão, as temperaturas de ebulição e fusão variam.
A primeira lei evidencia que se há mudança na temperatura não pode haver mudança de estado, pois ambas não ocorrem simultaneamente. A segunda lei afirma que cada substância possui sua temperatura característica, e de valor determinado, necessária para que o corpo inicie o processo de mudança de fase. Já a terceira lei trata da influência da pressão no valor determinado da temperatura, citado na segunda lei, onde variando a pressão, a temperatura dos pontos de fusão e de ebulição da substância variam também.
No gráfico a seguir, nota-se os processos de mudança de fase em que a temperatura permanece constante (de B a C e de D a E).
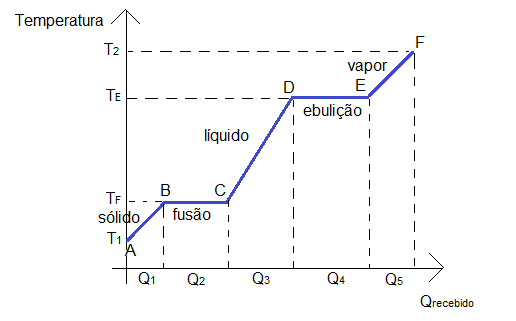
Notando que Q1 é o calor recebido para aumento de temperatura de A até B (calor específico), Q2 é o calor recebido para a mudança de estado de B a C (calor latente de fusão ou solidificação), Q3 é o calor para aumento de temperatura de C a D (calor específico), Q4 é o calor recebido para mudança de estado de D a E (calor latente de ebulição ou liquefação) e Q5 é o calor recebido para aumento de temperatura de E a F (calor específico).
Texto originalmente publicado em https://www.infoescola.com/fisica/calor-latente/