Considerando um recipiente de paredes rígidas, isolado termicamente, dividido por uma partição. Supondo que um dos compartimentos contenha gás e o outro esteja vazio.
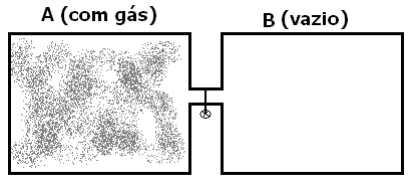
Se removemos a partição, o gás sofre o que é conhecido como expansão livre na qual não há realização de trabalho nem transferência de calor. Pela primeira lei da termodinâmica (ΔU = Q – W) como Q e W não sofrem alteração temos que a energia interna permanece inalterada. Para tentear saber se nesta expansão livre o gás sofre variação de temperatura o cientista Joule fez alguns experimentos em 1843, experimentos conhecidos como efeito Joule.
Para tentar constatar alguma relação entre energia interna e variação de volume ou de pressão, em sua experiência original Joule imergiu dois vasos ( como mostrados na figura), um com um gás e o outro foi feito vácuo, em banho-maria. A temperatura foi medida antes e depois da variação de temperatura da água. Como a diferença entre o calor específico da água e do recipiente Joule nada pode aferir com este experimento.
Hoje sabe-se que a energia interna de um gás real depende da pressão ou do volume, assim como da temperatura. Entretanto, a dependência da pressão e do volume é muito pequena, e a dependência com a temperatura é muito alta. Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre.
Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Vamos calcular a variação de energia interna de um corpo entre duas adiabáticas.
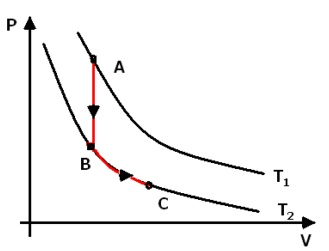
ΔUAB = Qv = mcΔT
ΔUBC = 0 (adiabática)
Portanto só há variação de energia interna no processo AB onde há variação de temperatura.
Texto originalmente publicado em https://www.infoescola.com/fisica/energia-interna-de-um-gas/