Existem dois processos distintos que podem variar a energia interna (U) de um corpo. São eles:
- calor (Q): processo térmico;
- trabalho (τ): processo mecânico.
O calor é devido ao contato entre corpos com temperaturas diferentes, havendo a transferência de energia térmica, até que haja o equilíbrio dessas temperaturas.
O trabalho envolve a aplicação de forças, provocando deslocamentos, como no caso da força exercida em um êmbolo (este se movimenta devido a variação de pressão, gerada pela força).
O primeiro princípio da termodinâmica busca elucidar como estes dois processos de intervenção na energia interna do corpo acontecem, mediante o princípio da conservação de energia, o qual afirma que a energia nunca é gerada ou perdida, apenas transformada de uma forma em outra.
Julius Robert von Mayer (1814-1878) e James Prescott Joule (1818-1889) dividem os créditos da formulação da primeira lei da termodinâmica. Ambos chegaram as mesmas conclusões, por meios diferentes. Eles concluíram que
- o calor é uma fonte de energia;
- esta energia é conservada.
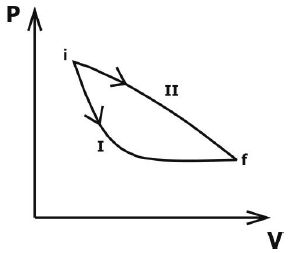
Considere, por exemplo, que um sistema receba 100 joules em forma de calor (Q). Após isso, ele realiza um trabalho (τ), utilizando 60 joules. Os 40 joules restantes permanecem retidos no sistema, armazenados em forma de energia interna (ΔU). Desta forma, percebe-se que a energia em forma de calor se conservou, pois não foi perdida, apenas transformada em trabalho e variação da energia interna do próprio sistema. Assim,
- energia em forma de calor (Q): entra no sistema;
- variação de energia interna (ΔU): permanece no sistema;
- energia em forma de trabalho (τ): sai do sistema.
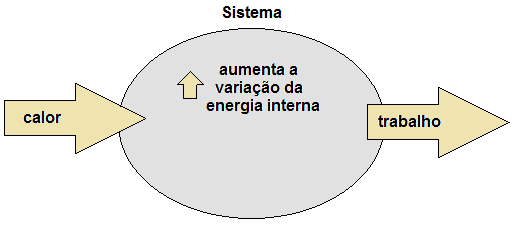
Figura 1. Conservação da energia pelo princípio da termodinâmica.
Logo, o calor é equivalente a soma das duas formas de energia em que ele se transforma:
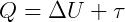
Ou ainda, a diferença entre energia que entra (Q) e a energia que sai (τ), é igual a variação da energia interna (ΔU) que permanece no sistema:
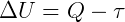
Por meio destas equações, temos o enunciado da Primeira Lei da Termodinâmica:
"Em um sistema, a variação de sua energia interna é a diferença entre o calor trocado com o meio e o trabalho realizado pela força que o sistema exerce em sua vizinhança."
Considerando a primeira equação, podemos fazer o seguinte estudo dos sinais:
| Q > 0 | energia térmica recebida pelo sistema |
| Q < 0 | energia térmica cedida pelo sistema |
| τ > 0 | trabalho realizado pelo sistema |
| τ < 0 | trabalho realizado sobre o sistema |
| ∆U > 0 | aumento na temperatura do sistema (aquecimento) |
| ∆U < 0 | redução na temperatura do sistema (resfriamento) |
A Primeira Lei da Termodinâmica foi estabelecida especialmente para os sistemas gasosos. Contudo, ela pode ser aplicada em quaisquer sistemas que envolvam calor, trabalho e variação da energia interna.
Texto originalmente publicado em https://www.infoescola.com/fisica/primeira-lei-da-termodinamica/