Todos os materiais possuem uma enorme energia guardada em si. Por mais que observamos um objeto e ele pareça parado, em seu interior há uma constante movimentação de suas moléculas, independentemente de seu estado físico. Esta movimentação pode ser de vibração, de rotação e até de translação, no caso dos gases. Pelo seu movimento em si, cada molécula possui energia cinética e, devido ao seu movimento em relação as moléculas vizinhas, possui energia potencial.
Ainda existe a energia que se caracteriza pelo simples fato de a substância existir e ter sua massa, dada pela equação de Einstein (E = m.c²), cuja equivalência entre massa e energia são relacionadas pelo quadrado da velocidade da luz c. Há também outros tipos de energias, não especificadas aqui, que podem existir no corpo.
A energia térmica (ou energia interna) é a soma de todas as energias presentes em uma substância, seja ela cinética, potencial, pela sua massa, entre outras. Em um gás perfeito, a energia térmica é composta apenas pela energia cinética, não havendo a interação que proporciona a energia potencial (distância média das partículas é maior no gás). Assim, a energia térmica de um gás perfeito, a qual é a energia cinética de translação das moléculas, é dada pela equação:
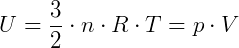
Logo, concluímos:
- A energia térmica de um gás perfeito, com um número n de mols, depende apenas de sua temperatura (Lei de Joule), pois R é a constante dos gases perfeitos.
- A energia térmica de um gás perfeito, com um número n de mols, é diretamente proporcional a temperatura absoluta do gás.
É importante ressaltar que no processo de mudança de estado físico há variação da energia térmica, embora a temperatura permaneça constante.
Podemos ainda calcular a relação entre a temperatura do gás perfeito e a velocidade média de suas partículas. Seja a equação da energia cinética a seguir:
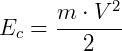
Igualando a energia cinética com a energia térmica, obtemos:
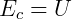
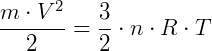
Como n = m/M, sendo m a massa total do gás e M a massa de um mol desse gás, então:
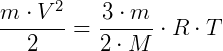
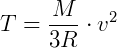
Dessa forma, observa-se que a temperatura do gás perfeito é diretamente proporcional ao quadrado da velocidade média das moléculas do gás.
A energia térmica é uma função de ponto (de estado) em um sistema termodinâmico, ou seja, não depende do estado intermediário do processo, apenas do estado atual em que se encontra. Por este motivo, em um processo cíclico, a variação da energia térmica é nula. Na maior parte das vezes o interesse está em calcular a variação da energia térmica, e não a energia térmica em sí.
Texto originalmente publicado em https://www.infoescola.com/fisica/energia-termica/