Quando duas ou mais fases de uma substância estão em contato, ocorre naturalmente uma transferência de massa entre as fases. Essa transferência ocorre de forma espontânea até um determinado ponto onde não é possível mais verificar nenhuma mudança nas fases do sistema. Quando isso ocorre dizemos que temos um equilíbrio de fases, onde o potencial químico é igual em todo sistema.
Um exemplo simples de fases em equilíbrio é um recipiente fechado com água. Inicialmente a evaporação fará com que a água passe da fase líquida para fase gasosa, porém em um determinado instante a taxa de evaporação será igual à taxa de condensação e logo teremos um equilíbrio de fases. O vapor de uma substância em equilíbrio com sua fase condensada chamamos a pressão parcial da substância de pressão de vapor.
A água pode ser usada para um segundo exemplo de equilíbrio de fases. A zero graus temos gelo e água coexistindo num mesmo sistema, à medida que fornecemos calor o gelo será transformado em água, mas o sistema permanecerá a zero graus. Quando todo gelo for consumido o fornecimento de calor elevará a temperatura da água. Esse comportamento é típico de substâncias puras.
Embora os equilíbrios de fase mais usuais sejam aqueles que envolvem duas fases, como os exemplificados acima, toda substância possui uma determinada condição de temperatura e pressão onde as três fases, sólida, líquida e gasosa podem ser verificadas ao mesmo tempo, a esse ponto damos o nome de ponto triplo. O cicloexano, por exemplo, tem seu ponto triplo por volta da temperatura de 6 ºC e pressão de 5 kPa.
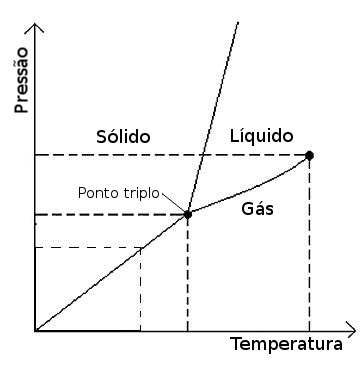
Diagrama de fases de uma substância pura qualquer.
Uma forma gráfica de visualizar a relação das fases de uma substância é o chamado diagrama de fases. Um diagrama de fase relaciona pressão e temperatura com a fase da substância naquelas condições. As linhas do diagrama dividindo as fases indicam condições onde ambas as fases podem ser observadas, caso três linhas se cruzem temos um ponto triplo. Existem também um ponto crítico onde perde-se a distinção entre a fase líquida e gasosa.
Perturbações no equilíbrio de fases em geral tem comportamento fácil de prever. Aumento de temperatura, por exemplo, faz com que a substância tenda para o estado com menor agregação, líquido ou gasoso. Por outro lado um aumento de pressão faz com que a substância prefira ficar na fase com menor densidade, em geral isso significa fase sólida, mas isso não é verdade para todas substâncias. A água por exemplo é mais densa na fase líquida, por isso o gelo boia na água, logo quando pressionamos um cubo de gelo ele tende a derreter.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/equilibrio-de-fases/