Algumas soluções cujos componentes são voláteis respeitam uma relação que diz que a razão entre pressão parcial de vapor de cada componente e a pressão de vapor do componente puro é aproximadamente igual a fração molar do componente em questão. Essa relação foi descrita pelo químico francês, François Raoult e soluções deste tipo são chamadas soluções ideais. A expressão matemática dessa relação, chamada de Lei de Raoult é:
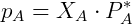
Onde 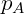 ,
, 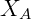 e
e 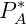 são a pressão de vapor, a fração molar e a pressão de vapor puro do componente A respectivamente.
são a pressão de vapor, a fração molar e a pressão de vapor puro do componente A respectivamente.
Foi observado que em soluções diluídas reais a pressão de vapor também é proporcional à fração molar do componente, entretanto a constante de proporcionalidade não é a pressão de vapor da substância pura e sim uma constante empírica. Essa relação é conhecida como Lei de Henry e estabelece que:
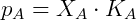
Onde 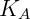 é chamada constante de Henry e depende da substância e temperatura. Nesse caso o composto A é um soluto em concentrações baixas. Soluções onde o soluto obedece a lei de Henry e o solvente obedece a lei de Raoult são chamadas de soluções diluídas ideais.
é chamada constante de Henry e depende da substância e temperatura. Nesse caso o composto A é um soluto em concentrações baixas. Soluções onde o soluto obedece a lei de Henry e o solvente obedece a lei de Raoult são chamadas de soluções diluídas ideais.
A lei de Henry permite, entre outras coisas, o estudo da solubilidade de gases. É possível notar que a quantidade de um gás dissolvido é proporcional a pressão daquele gás na superfície da solução. Isso é coerente com a noção de equilíbrio químico, onde podemos imaginar a reação de dissolução do gás A em água:
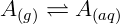
Como esperado o aumento da pressão de A(g) deve aumentar a quantidade de A(aq). A segunda observação experimental é que a constante de Henry diminui com a temperatura. Isso pode ser explicado devido à agitação térmica, soluções mais quentes possui uma agitação molecular maior e portanto o gás se desprende do líquido mais facilmente.
Para aplicações práticas a lei de Henry é utilizada em uma forma ligeiramente diferente. A fração molar do composto é substituída pela molalidade, representada por b:
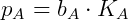
Onde molalidade é definida como a quantidade de mols do soluto dividida pela massa de solvente em quilogramas.
A tabela a seguir apresenta alguns valores de K para gases à 25 °C:
| Gás | K (kPa.kg.mol-1) |
| CO2 | 3,01 x 103 |
| H2 | 1,28 x 105 |
| N2 | 1,56 x 105 |
| O2 | 7,92 x 104 |
Como pode ser verificado na equação anterior, quanto menor o K mais solúvel o gás. Vemos então que, para as moléculas da tabela, que são apolares, quanto maior e mais polarizável sua estrutura maior sua solubilidade em água.
Como exemplo, podemos obter a solubilidade do CO2 com os dados da tabela considerando que seja aplicada uma pressão parcial de 5 kPa sobre a solução:
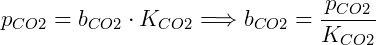
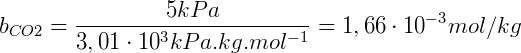
Que pode ser expresso em concentração molar conhecendo a densidade da solução, assumindo que seja 1,00 kg/L a solubilidade do CO2 nessas condições é 1,66 mmol/L.
Referencia
ATKINS, P. W.; PAULA, Julio de. Físico-química. 8. ed. Rio de Janeiro: LTC, 2008. 2 v. ISBN 9788521616009 (v.1).
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/lei-de-henry/