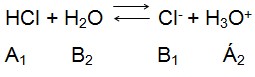A grande vantagem da teoria dos ácidos e bases de Brönsted - Lowry está na abordagem do meio em que estão presentes estas substâncias. Enquanto a teoria clássica ficou restrita a meios aquosos, onde ácidos liberam íons hidrogênio e bases liberam hidroxila, esta foi mais além, mostrando que o próton de hidrogênio é o responsável pelo caráter ácido-básico. Tendo em vista que provou ser uma teoria que se adapta a qualquer solvente prótico enquando nesta categoria espécies químicas (substância, molécula ou íon) que até então a teoria clássica foi insuficiente para explicar.
Apresenta explicação do comportamento das espécies químicas até então aguardavam alguma definição pelas teorias existentes. Segundo os cientistas, J.N. Brönsted na Dinamarca e T.M. Lowry na Inglaterra, no ano de 1923 de maneira independente introduziram o conceito de ácido-base, enunciando em sua teoria que:
- Ácido é toda espécie química doadora de prótons H+.
- Base é toda espécie química receptora de prótons H+.
De acordo com essa definição, é evidente, que ambos coexistam na forma de par conjugado ácido-base, ou seja, obrigatoriamente a base recebe o próton doado pelo ácido, caso contrário não se aplica a teoria. É importante ainda salientar que algumas espécies podem comportar-se como ácido ou base sendo chamada de anfótero, esse comportamento é observado em função do tamanho minúsculo do íon que por estar no centro de um campo elétrico tem uma afinidade maior com moléculas, que não tem seus elétrons compartilhados. A equação genérica expressa de maneira conveniente o fundamento da teoria:
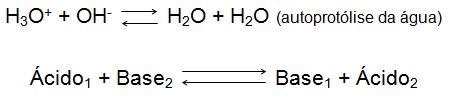 Esta equação mostra que a Base2 é uma receptora de prótons doados pelo Ácido1, confirmando assim a existência de um para conjugado, esta também pode ser considerada uma equação de neutralização ou protólise dos ácidos e bases. Em virtude de esta definição ser adaptável a diversos tipos de reação, não é necessário postulados como hidrolise, neutralização e dissociação, por simplesmente, a doação e recepção de um próton ser adaptáveis para as reações em geral. Para melhor entendimento segue-se as reações abaixo:
Esta equação mostra que a Base2 é uma receptora de prótons doados pelo Ácido1, confirmando assim a existência de um para conjugado, esta também pode ser considerada uma equação de neutralização ou protólise dos ácidos e bases. Em virtude de esta definição ser adaptável a diversos tipos de reação, não é necessário postulados como hidrolise, neutralização e dissociação, por simplesmente, a doação e recepção de um próton ser adaptáveis para as reações em geral. Para melhor entendimento segue-se as reações abaixo:
O cloreto de hidrogênio, não é condutor de corrente elétrica, portanto é um composto covalente, em razão de sua reação com água observa-se a formação de íons exatamente como a reação acima mostra. Simplificando, o HCl funciona como um ácido doando seu próton para água que comporta-se como base recebendo o mesmo, e liberando Cl- que é a base conjugada do HCl e água por sua vez recebe o próton formando o H3O+.
Ainda através desta reação é possível observar a força de um ácido, que nada mais é do que a sua capacidade de conduzir corrente, em função de sua protólise, sendo na verdade os responsável pela condução de corrente, caráter ácido e base somente o próton.
Concluindo uma reação de protólise ou neutralização é simplesmente a ligação entre H+ e OH-, formando água, isto representa um método seguro para equilibrar equações de neutralização.
Bibliografia:
Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .
James Brady, Humiston Gerard E. QUÍMICA GERAL - 2ª EDIÇÃO.
Texto originalmente publicado em https://www.infoescola.com/quimica/acidos-e-bases-de-bronsted-lowry/