Os aldeídos são compostos que apresentam o grupamento carbonila (C=O) na extremidade da cadeia, ou seja, o carbono da carbonila é primário. O odor dos aldeídos que têm baixo peso molecular é irritante, porém, à medida que o número de carbonos aumenta, torna-se mais agradável. Se apresentam sob a forma gasosa, líquida ou sólida e os aldeídos de cadeias pequenas são solúveis em água devido as ligações hidrogênio que fazem, ganhando apolaridade conforme a cadeia de carbonos aumenta. Um fato interessante sobre os aldeídos é que as suas moléculas não realizam ligação hidrogênio entre si, atraindo-se por forças de dipolo permanente.
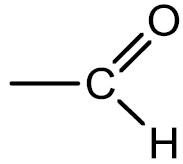
Carbonila, o grupo funcional dos aldeídos.
Devido a hibridização do carbono vicinal ser sp2, essa ligação tem caráter polar – o carbono está com caráter positivo: eletrofílico – que é responsável pela grande reatividade desta classe de compostos. Em geral, devido ao tamanho do grupo hidrogênio frente ao grupo alquila, o maior espaço torna mais fácil atacar carbonila de aldeídos e, em reações de adição nucleofílica, os aldeídos reagem mais rapidamente que as cetonas. O formaldeído por possuir hidrogênio dos dois lados é o aldeído mais reativo de todos.
Os aldeídos com pelo menos um hidrogênio α (hidrogênio ligado no carbono vizinho ao grupo carbonila) encontram-se em um equilíbrio dinâmico com um isômero denominado enol. Esse equilíbrio é conhecido como tautomeria aldo-enólica.
Nomenclatura dos aldeídos
Prefixo + tipo de ligação + AL
Como o grupo funcional dos aldeídos sempre está na ponta da cadeia, para nomear basta iniciar a contagem pelo carbono na extremidade do grupo funcional.
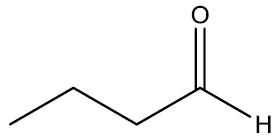 |
Butanal |
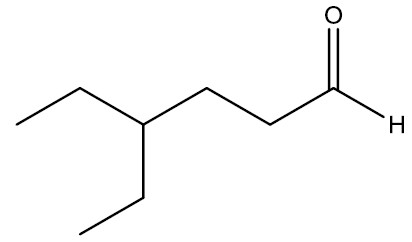 |
4-etil-hexanal |
Os quatro aldeídos mais simples apresentam nomes usuais formados pelos prefixos: form, acet, propion, butir, seguidos da palavra aldeído.
| Metanal (Formaldeído) | Etanal (Acetaldeído) |
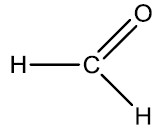 |
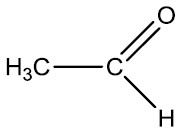 |
| Propanal (Propionaldeído) | Butanal (Butiraldeído) |
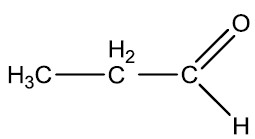 |
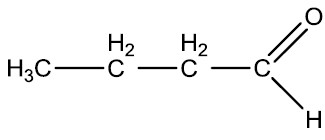 |
Se por ventura houverem dois grupos funcionais na cadeia (um em cada extremidade), este aldeído receberá o infixo di, como abaixo:
| Pentanodial |
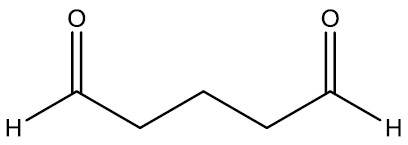 |
Na nomenclatura usual, podemos usar a palavra ‘aldeído’ seguida do nome usual do ácido carboxílico correspondente. Note que este tipo de nomenclatura só é válida para aldeídos de cadeia normal e saturada, pois não há a possibilidade de indicar ramificações e insaturações nela.
| Aldeído fórmico | Aldeído propiônico |
 |
 |
Os aldeídos podem ser obtidos através da hidratação de alcinos, pela ozonólise de alcenos ou pela oxidação de álcoois.
Alguns aldeídos importantes
Metanal: é um gás incolor extremamente irritante para as mucosas que, quando dissolvido em água, forma uma solução que tem a propriedade de desnaturar as proteínas, o que as torna resistentes a ação de bactérias e permite a conservação de tecidos vivos para estudo em medicina e veterinária e também em processos de embalsamamento. Também é usado como desinfetante e na indústria de plásticos e resinas. A solução de formol possui concentração de no máximo 40% em massa.
Etanal: é um gás de cheiro forte e solubilidade em água. É usado como matéria-prima na indústria de medicamentos e pesticidas, sendo também utilizado na fabricação de espelhos. O etanal é capaz de reduzir os sais de prata através de reação e os fixa no espelho para reflexão da imagem.
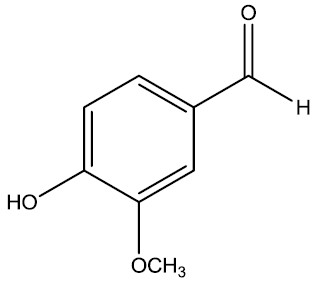
Vanilina: é um aldeído fenólico de coloração branca e odor característico de baunilha. É extraída naturalmente da vagem da baunilha, mas sua forma sintética também é industrialmente usada como um agente aromatizante em alimentos, bebidas e produtos farmacêuticos.
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/aldeidos/