Em Química, algumas substâncias podem ser utilizadas com indicadoras, ou seja, têm a sua cor alterada de acordo com a escala de pH a qual foi submetida. O azul de bromotimol é uma dessas substâncias indicadoras.
O azul de bromotimol é um indicador ácido-base orgânico sintético. É representado pela fórmula química C27H28Br2O5S, apresenta-se sólido em seu estado puro e em condições ambientes, praticamente inodoro, é parcialmente solúvel em água e solúvel em alguns solventes orgânicos e em soluções alcalinas. Sua estrutura é formada por duas moléculas de timol (monoterpeno fenólico), que contem um átomo de bromo (Br) unido ao anel aromático e um anel benzênico ligado a um éster sulfônico cíclico. Comumente, essa substância é comercializada sob a forma de um pó químico branco.
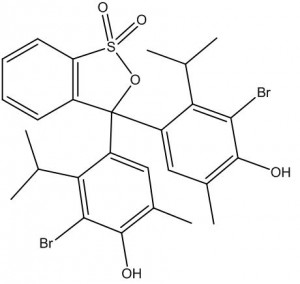 Assim como a maior parte dos indicadores, o azul de bromotimol é um ácido orgânico fraco; em meio ácido (nesse caso, abaixo de 6,0), apresenta coloração amarela, enquanto que em meio básico (acima de 7,6), a cor muda para azul. A mudança da cor ácida para a básica ou da básica para a ácida acontece em certos intervalos de pH, denominados faixas ou intervalos de viragem, que no caso do azul de bromotimol é de 6,0 a 7,6. Quando o valor do pH está dentro da faixa de viragem, forma-se uma cor intermediária (esverdeada). Essa alteração da coloração apenas pode ser percebida pela visão humana quando varia aproximadamente duas unidades de pH.
Assim como a maior parte dos indicadores, o azul de bromotimol é um ácido orgânico fraco; em meio ácido (nesse caso, abaixo de 6,0), apresenta coloração amarela, enquanto que em meio básico (acima de 7,6), a cor muda para azul. A mudança da cor ácida para a básica ou da básica para a ácida acontece em certos intervalos de pH, denominados faixas ou intervalos de viragem, que no caso do azul de bromotimol é de 6,0 a 7,6. Quando o valor do pH está dentro da faixa de viragem, forma-se uma cor intermediária (esverdeada). Essa alteração da coloração apenas pode ser percebida pela visão humana quando varia aproximadamente duas unidades de pH.
Uma das utilizações mais clássicas da solução de azul de bromotimol como indicadora ácido-base é a determinação do pH da água de aquários, piscinas, criadouros e tanques de peixes. Também se utiliza o azul de bromotimol no ramo da Obstetrícia com a finalidade de identificar uma desordem do parto conhecida como rompimento prematuro das membranas. Em laboratórios, é frequente o uso da substância como corante biológico para análises microscópicas realizadas em lâminas, o que facilita a visualização de paredes e núcleos celulares.
Referências:
http://paginas.fe.up.pt/~quimica2011/images/stories/Protocolo%20-%20O%20pH%20das%20%C3%A1guas%20do%20Planeta.pdf
http://pt.wikipedia.org/wiki/Azul_de_bromotimol#Prepara.C3.A7.C3.A3o_da_solu.C3.A7.C3.A3o_do_indicador
http://www.spq.pt/boletim/docs/boletimSPQ_100_085_24.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/azul-de-bromotimol/