Os compostos tensoativos ou surfactantes são substâncias orgânicas que apresentam como característica principal o fato de terem um comportamento anfifílico, ou seja, podem interagir tanto com substâncias polares quanto apolares. Essa propriedade é explicada pelo fato dessas moléculas apresentarem uma região hidrofóbica e outra hidrofílica. A parte hidrofóbica, que é uma cadeia carbônica interage com substâncias apolares, e a hidrofílica ou iônica com substâncias polares.
A estrutura orgânica de um tensoativo está esquematizada abaixo:
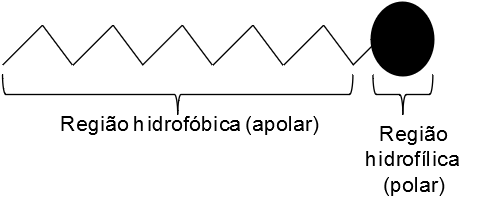
Figura 1: Representação da estrutura orgânica de um tensoativo.
A interação dos tensoativos está relacionada com o tamanho da cadeia do qual é formado e com sua afinidade pelo meio.
Esses compostos podem ser classificados em tensoativos aniônico, catiônicos, não iônicos ou anfóteros. Os aniônicos ao serem dissolvidos em água, dissociam-se de forma que a cadeia carbônica forme um ânion. Um exemplo desse tipo de tensoativo é o lauril ou dodecilsulfato de sódio, muito utilizado em xampus.
H3C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C-OSO3Na ⇒
H3C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C-OSO3 - + Na+
Figura 2: Reação que representa a dissociação do lauril em água
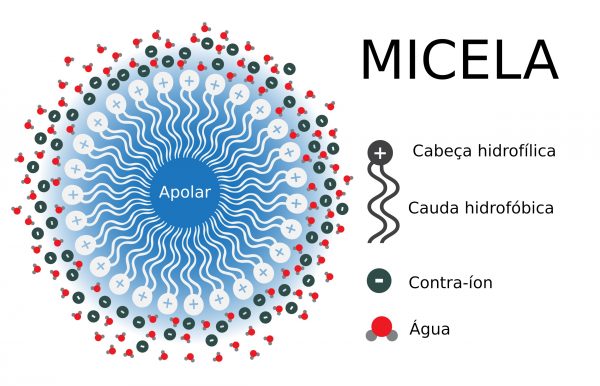
O funcionamento de um xampu ilustra bem o comportamento dos compostos tensoativos e a limpeza do cabelo é explicada da seguinte forma: a parte hidrofóbica da molécula interage com a sujeira e a gordura, e a parte polar com a água, formando uma micela esférica, onde a sujeira se concentra no interior e e forças eletrostáticas mantém a água na parte externa, assim quando enxaguamos o cabelo a micela é arrastada levando a sujeira embora. O funcionamento de detergentes de lavar louça e sabões também funciona da mesma forma.
No caso dos tensoativos catiônicos, ao serem dissolvidos em água, a cadeia carbônica forma um cátion. Um exemplo são os sais halogenados quaternários de amônio, que estão presentes em condicionadores e soluções antimicrobianas. Os surfactantes não iônicos não possuem cargas que causem influencia no meio, dessa forma ao serem dissolvidos em água não se ionizam. Como exemplo, podemos citar os nonilfenóis, as amidas e ácidos graxos etoxilados. Já os surfactantes anfóteros, por apresentarem na mesma cadeia um grupo carboxila e um grupo amônio quaternário, pode dependendo do pH da solução apresentar um comportamento catiônico e aniônico. Essa propriedade faz com ele seja bastante utilizado na indústria de cosméticos, agindo como estabilizador de espuma, agente de limpeza e emoliente.
O comportamento anfifílico dos tensoativos confere a eles a capacidade de interagir entre meios com polaridades diferentes, podendo ser utilizados como conciliadores de fases imiscíveis, uma vez que tem a capacidade de reduzir a tensão superficial. Essa característica permite a formação de emulsões, espumas, suspensões, microemulsões, podendo ainda ser utilizados para formação de filmes líquidos, umectação e limpeza de superfícies. Entre as principais aplicações dos tensoativos, além da já mencionadas, temos também a produção de agroquímicos, tintas, alimentos, remédios, óleos lubrificantes, entre outros.
Referencias bibliográficas:
Atkins, P. W.; Jones, Loretta . Princípios de química: questionando a vida moderna e o meio ambiente, volume único. 3. ed. Porto Alegre: Bookman, 2006.
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte B – Físico Química. Editora Saraiva 2005.
Solomons, T. W. G., Fryhle, C. B. Química Orgânica. Vol 1, 7. ed. Rio de Janeiro, LTC, 2001.
Daltin, D. Tensoativos: química, propriedades e aplicações. SãoPaulo, Editora Edgar Blunch, 2012.
Texto originalmente publicado em https://www.infoescola.com/quimica/compostos-tensoativos/