Na química dos compostos de carbono, a presença de elementos que não são o carbono e o hidrogênio não é, em si, algo incomum. Na natureza a variedade de compostos orgânicos que apresentam outros átomos ligados à cadeia carbônica é absurdamente grande, e essa propriedade não é exclusiva de apenas um ou outro elemento. Oxigênio, nitrogênio, enxofre, cloro, dentre outros, são encontrados em associação ao carbono e suas cadeias.
O foco deste artigo são as relações que o átomo de oxigênio possui com o carbono e hidrogênio, em especial àquelas ligadas à natureza química das carboxilas.
A presença de oxigênio em uma cadeia carbônica pode se dar de algumas formas, como pode ser visualizado na tabela a seguir:
Funções orgânicas oxigenadas – grupos funcionais e fórmulas.
| Grupo funcional | Nomenclatura | Fórmula estrutural, molecular e massa molar |
| Álcool | Etanol | 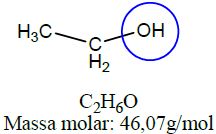 |
| Enol | Prop-1-en-1-ol | 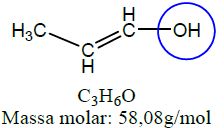 |
| Fenol | Fenol | 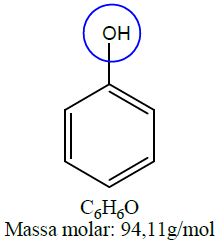 |
| Éter | Etóxietano | 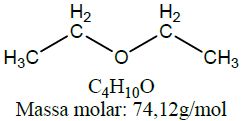 |
| Aldeído | Metanal | 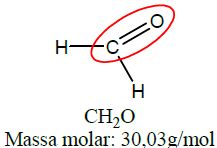 |
| Cetona | Propanona | 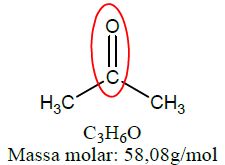 |
| Ácido carboxílico | Ácido etanóico | 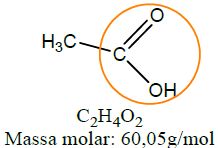 |
| Sal orgânico | Etanoato de sódio | 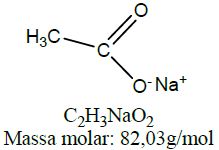 |
| Anidrido orgânico | Anidrido etanóico | 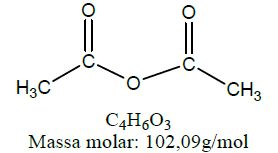 |
| Éster | Butanoato de etila | 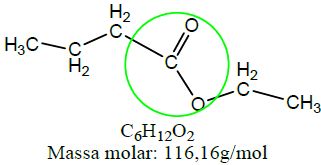 |
* Circulados em: azul (hidroxila); vermelho (carbonila); laranja (carboxila), verde (carboalcoxila)
As funções álcool, enol e fenol apresentam em sua estrutura ao menos uma hidroxila, enquanto aldeídos e cetonas apresentam em sua estrutura a carbonila.
A carboxila, característica dos ácidos carboxílicos, é na maioria dos casos, o seu sítio reativo. Isso ocorre devido à substituição do grupo hidroxila (–OH) ou do átomo de hidrogênio por outros átomos ou cadeias carbônicas. Na tabela acima, os três grupamentos funcionais abaixo do ácido carboxílico (sal orgânico, anidrido orgânico e éster) podem ser obtidos a partir de moléculas de ácidos. O sal orgânico etanoato de sódio é obtido através da reação de ácido etanoico com hidróxido de sódio, sendo este mecanismo muito semelhante às reações de neutralização dos ácidos inorgânicos.
Anidridos orgânicos são formados por desidratação intramolecular ou intermolecular, ocorrendo saída de molécula de água e concomitante ligação entre a carbonila e o oxigênio.
Na produção de ésteres é necessária a presença de uma molécula de ácido carboxílico, uma molécula de álcool e, geralmente, um catalisador ácido (H2SO4, por exemplo). Nesta reação, denominada esterificação, a hidroxila presente na carboxila interage com o átomo de hidrogênio, presente na hidroxila do álcool, formando água. O oxigênio do álcool se liga à carbonila restante do ácido, formando o éster. Na tabela abaixo encontram-se as reações descritas estruturalmente.
Reações de ácidos carboxílicos e seus derivados diretos.
| 1. Neutralização (produz sal orgânico) |
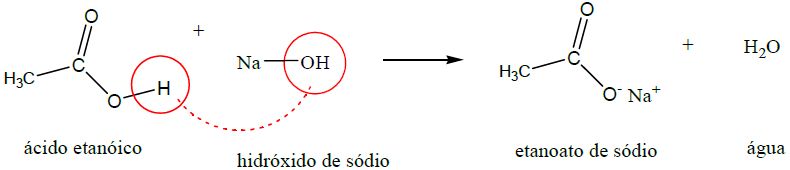 |
| 2. Desidratação (produz anidrido) |
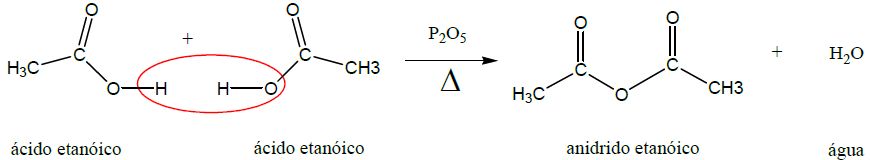 |
| 3. Esterificação (produz éster) |
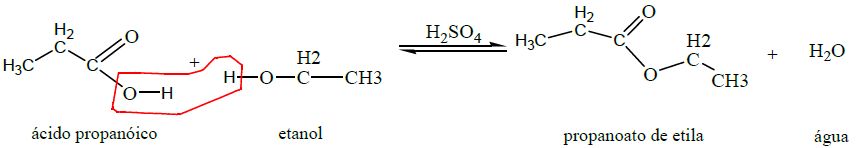 |
Por apresentar o fenômeno da ressonância na carboxila (mostrado abaixo), a acidez dos ácidos carboxílicos se torna mais acentuada que a de seus alcoóis correspondentes. Concomitantemente, o efeito indutivo da carbonila atrai elétrons, favorecendo a dissociação iônica e aumentando o caráter ácido. A dimerização de ácidos carboxílicos, através das ligações de hidrogênio, influencia nas temperaturas de ebulição dos mesmos (em comparação com alcoóis de mesma cadeia carbônica).
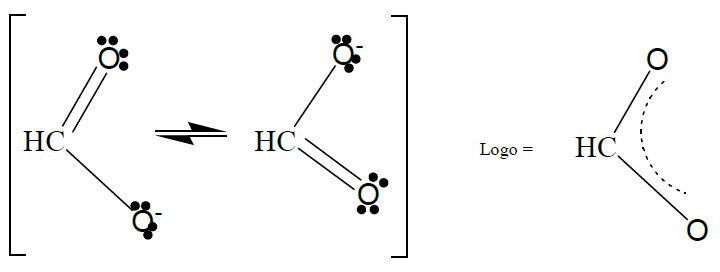
Ressonância na carboxila, em molécula-modelo de ácido metanoico.
A indústria produz diversos ácidos carboxílicos, mas alguns, por apresentarem relevância no contexto socioeconômico, estão listados abaixo:
- Ácido metanoico: Indústria do couro e lã; cervejarias/vinícolas (bactericida).
- Ácido etanoico: Indústria alimentícia e química
- Ácido benzoico: Síntese orgânica; conservante.
- Acido linoleico: Indústria alimentícia
- Acido acrílico: Indústria de polímeros
- Ácido sórbico: Indústria alimentícia
Referências:
CAMPOS, M.M; AMARAL, L.F.P. [et.al]. Fundamentos de Química orgânica. São Paulo: Edgard Blücher, 1980. p. 363 – 386.
LISBOA, J. C. F. Química, 3º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p.115 –119.
Texto originalmente publicado em https://www.infoescola.com/quimica/carboxila/