“A química moderna assim explica: há uma combinação das substâncias e não uma decomposição. Contudo, esse ponto era ignorado pela Ciência de antes do século XVII, que dava maior ênfase aos aspectos qualitativos, desprezando as quantidades”1. A Lei da Conservação de Massa entre reagentes e produtos foi proposta por volta de 1775 por Antoine Laurent Lavoisier e é popularmente enunciada da seguinte maneira: na natureza, nada se perde e nada se cria, tudo se transforma.
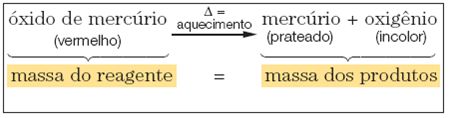
Lavoisier formulou essa lei depois de realizar uma experiência com óxido de mercúrio (reagente), o qual, antes de ser submetido ao aquecimento, teve sua massa determinada.
Quando colocado em um sistema fechado; mediante o aquecimento desse reagente, Lavoisier obteve mercúrio e oxigênio (produtos), que, ao final da reação, também tiveram suas massas quantificadas.
Lavoisier “repetiu a experiência muitas vezes, provocou outras reações, medindo sempre com balanças a massa das substâncias a serem testadas, e a massa dos produtos obtidos”1. Em função desta e de várias outras experiências, concluiu então que:
Num sistema fechado, a massa total dos reagentes é igual à massa total dos produtos
Essa foi a primeira das leis das combinações químicas ou leis ponderais e, a partir dela, outras foram surgindo para explicar as regularidades que ocorrem nas combinações químicas, como por exemplo a Lei de Proust e a Lei de Graham.
A lei da conservação de massas pode ser demonstrada laboratorialmente, sem a necessidade de maior sofisticação instrumental, conforme descrição abaixo:
1. Colocar 10 mL de hidróxido de sódio (NaOH) de concentração 0,20 M no interior de um erlenmeyer. Adicionar algumas gotas de fenolftaleína. Haverá formação da coloração rósea característica.
2. Introduzir 10 mL de ácido clorídrico (HCl) de concentração0,21 M em um tubo de ensaio. Depositar cuidadosamente esse tubo no interior do erlenmeyer de maneira que fique apoiado.
3. Fechar o erlenmeyer com uma rolha apropriada e levar o conjunto a uma balança. Anotar a massa inicial.
4. Inclinar cuidadosamente o erlenmeyer fechado a fim de permitir a saída do HCl contido no tubo de ensaio, que reage ao entrar em contato com o NaOH presente no erlenmeyer, alterando a coloração da solução, de acordo com a equação de neutralização abaixo:
HCl(aq) + NaOH(aq) → NaCl(s) + H2O(l)
5. Levar novamente o conjunto à balança. Anotar a massa final e comparar com a inicial.
O experimento descrito acima permite observação da conservação de massa entre reagentes e produtos na ocorrência de uma reação química, identificada neste caso pela mudança de coloração, conforme afirmara Lavoisier.
Referências:
1. http://www.fem.unicamp.br/~em313/paginas/person/lavoisie.htm
FELTRE, Ricardo, Química Geral, Vol. I, Ed. Moderna, 6° Ed., São Paulo/SP, 2004.
http://pt.wikipedia.org/wiki/Antoine_Lavoisier
Texto originalmente publicado em https://www.infoescola.com/quimica/conservacao-de-massa-experimental/