John Dalton foi um químico, físico e meteorologista inglês famoso por seus trabalhos sobre teoria atômica e daltonismo, doença que era portador e que foi batizada com seu nome. Entre outros tópicos Dalton estudou o comportamento de misturas gasosas, formulando sua famosa lei para esses sistemas. A Lei de Dalton ou Lei das pressões parciais diz que a pressão total de uma mistura de gases é igual a soma das pressões parciais de cada gás que a compõe. A pressão parcial de um gás por outro lado é definida como a pressão que o mesmo exerceria se estivesse sozinho no recipiente. Desta forma podemos escrever:
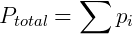
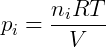
Onde pi é a pressão parcial do gás i. A pressão parcial pode também ser obtida de uma forma conveniente utilizando a fração molar do composto, que é a razão entre o número de mols deste sobre o número de mols total presente no gás.
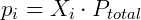
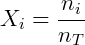
Como esperado, numa mistura de gases aquele em maior concentração exercerá maior pressão. Devido a esta relação a pressão parcial é muitas vezes usada como medida de concentração. Conhecendo a equação dos gases ideais é possível demonstrar essas relações de forma simples. Considere uma mistura gasosa:
A pressão total pode ser calculada da seguinte forma:
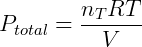
Num gás ideal, com exceção de colisões, não há interação entre as moléculas, além disso o volume de cada molécula é desprezível. Portanto a natureza da molécula ou partícula não influencia no comportamento do gás, apenas o número total dessas partículas é importante (nT). Expandindo a expressão anterior temos:
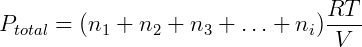
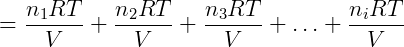
Cada termo da equação anterior é exatamente a pressão parcial de um dos componentes da mistura, podemos reescrever então:
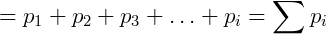
Vemos que a lei de Dalton é consistente com a lei dos gases ideais. Podemos verificar também a relação entre pressão parcial e fração molar da seguinte forma:
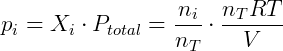
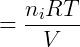
Portanto utilizando o modelo de gases ideal ou perfeitos a lei de Dalton pode ser facilmente verificada. É importante notar que essa lei vale apenas quando o modelo dos gases ideais também for válido, em gases reais interações intermoleculares não desprezíveis podem fazer com que a soma das pressões parciais não seja igual a pressão total do sistema.
O conceito de pressão parcial é útil em diversos outros tópicos da química, como por exemplo o equilíbrio químico com reagentes gasosos. Nesses casos a constante de equilíbrio é obtida pela razão da pressão parcial dos produtos pela pressão parcial dos reagentes.
Texto originalmente publicado em https://www.infoescola.com/quimica/lei-de-dalton/