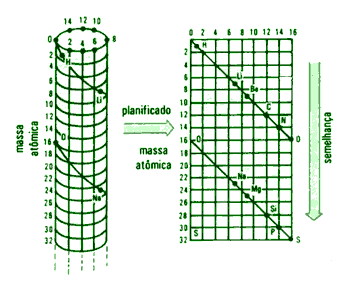
Em 1862, um geólogo francês, chamado Alexandre Chancourtois, organizou os elementos químicos conhecidos em ordem crescente de suas massas atômicas por uma linha espiral em volta de um cilindro. Esse arranjo ficou conhecido como Parafuso Telúrico, sendo o termo telúrico referente à terra.
Chancourtois baseava-se no peso atômico do elemento químico oxigênio, na época já estabelecido como 16. Assim, utilizou um cilindro, dividiu-o em 16 segmentos iguais, e marcou uma hélice na superfície desse cilindro, formando entre ela e seu eixo um ângulo de 45°. Sobre essa hélice dispôs os elementos químicos em ordem crescente de seus pesos atômicos. Percebeu então que “a hélice atravessava as geratrizes a distâncias cujos valores eram múltiplos de 16 e os elementos onde os pesos atômicos diferiam em 16 unidades, caíam na mesma geratriz”1. Observou também que o grupo de elementos de cada geratriz apresentava semelhanças em suas propriedades, ao menos àquelas comuns e conhecidas na época.
De acordo com as palavras de PERUZZO E CANTO, “ao redor do cilindro foram feitas dezesseis divisões, e os elementos com propriedades semelhantes apareciam uns sobre os outros em voltas consecutivas da espiral”2. Chancourtois sugeriu que suas propriedades estariam em direta relação com a posição em que os elementos ocupavam na sequencia. Entretanto, as regularidades encontradas por ele não poderiam ser observadas para todos os elementos, e a ideia foi descartada.
Por exemplo, os elementos químicos boro (B), berílio (Be) e lítio (Li), da mesma forma que os elementos alumínio (Al), magnésio (Mg) e sódio (Na), encontram-se em uma mesma geratriz, o que deveria conferir semelhanças em suas propriedades. Entretanto, apesar disso ocorrer entre alguns elementos, o grande número de irregularidades encontradas fizeram com que o trabalho de Chancourtois não recebesse maior atenção perante a comunidade científica da época. Entre essas irregularidades pode-se utilizar como exemplo as propriedades dos elementos Na e Al, os quais diferem em muitas de suas propriedades devido à suas valências distintas. Ao que se sabe hoje, o sódio é monovalente e forma sais com o cloro do tipo MCl, ao passo que o alumínio, trivalente, forma sais com o cloro do tipo MCl3.
Entretanto, com base nos textos que exploram o assunto, pode-se concluir que a razão principal da refutação de seu trabalho não concentrava-se apenas na questão experimental, mas na excessiva complexidade de seu trabalho, talvez para os métodos de se fazer ciência da época. E também torna-se de relevância mencionar que seu sistema também incluía compostos, a não apenas elementos químicos puros.
Referências:
1. http://www.laifi.com/laifi.php?id_laifi=628&idC=6120#
2. PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
FELTRE, Ricardo; Fundamentos da Química, vol. Único, Ed. Moderna, São Paulo/SP – 1990
Texto originalmente publicado em https://www.infoescola.com/quimica/parafuso-telurico-de-chancourtois/