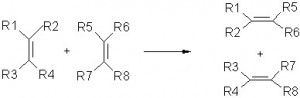
 As reações de dupla-troca ou de metátese se caracterizam por haver, literalmente, trocas entre os elementos de cada molécula envolvida na reação. Ou seja, determinados átomos, íons ou radicais mudam de posição passando para a outra molécula substituindo o átomo, íon ou radical que estava naquela posição. Segue abaixo uma reação genérica que exemplifica a reação de metátese:
As reações de dupla-troca ou de metátese se caracterizam por haver, literalmente, trocas entre os elementos de cada molécula envolvida na reação. Ou seja, determinados átomos, íons ou radicais mudam de posição passando para a outra molécula substituindo o átomo, íon ou radical que estava naquela posição. Segue abaixo uma reação genérica que exemplifica a reação de metátese:
AB + CD -> AC + BD
Onde, AB e CD não podem ser sólidos ao mesmo tempo, mas uma combinação entre líquido e sólido: líquido+líquido, líquido+sólido ou sólido+líquido. E, ao mesmo tempo, como característica de uma reação de dupla-troca os produtos devem ser diferentes dos reagentes em pelo menos um dos seguintes quesitos:
1) AC e/ou BD deve(m) ser menos solúvel(is) que AB e/ou CD.
A reação entre ácido sulfúrico e hidróxido de bário forma como produto o sulfato de bário: um sal branco, que é altamente insolúvel e precipita no fundo do recipiente:
H2SO4(aq) + Ba(OH)2(aq) -> 2H2O(l) + BaSO4(s)
2) AC e/ou BD deve(m) ser eletrólito(s) mais fraco(s) que AB e/ou CD.
Esse quesito significa que um dos produtos da reação tem que ser menos ionizável, ou seja, ser um mau condutor de eletricidade em relação aos reagentes. A reação de neutralização entre o ácido clorídrico e hidróxido de sódio (soda cáustica) forma NaCl (ótimo condutor se em solução ou fundido) e água líquida que é péssima condutora e difere-se dos demais:
HCl(aq) + NaOH(aq) -> NaCl(aq) + H2O(l)
3) AC e/ou BD deve(m) ser mais volátil(eis) que AB e/ou CD.
Na reação entre bicarbonato de sódio e ácido clorídrico (caso comum quando temos azia e ingerimos um antiácido):
NaHCO3(s) + HCl(aq) -> NaCl(s) + H2CO3(aq) -> NaCl(s) + H2O(l) + CO2(g)
Observa-se também que há uma reação de decomposição do ácido carbônico, já que é muito instável (volátil) e tende formar água líquida e dióxido de carbono gasoso.
Uma outra grande característica das reações de dupla troca é que os reagentes geralmente não são óxidos, pois estes tendem a reagir em síntese e não em troca. Logo, são reações de dupla-troca aquelas onde reagem: um ácido e uma base (neutralização), dois sais (com um insolúvel), um sal e um ácido (formando outro sal e outro ácido) ou um sal e uma base (formando outro sal e outra base).
Dentre todos os indicadores de reação de dupla-troca, a formação do precipitado é o mais fácil de ser identificado. Uma vez que a detecção de produtos mais voláteis ou menos ionizáveis só é possível através de experimentos complementares. Sendo, portanto, as reações que produzem este efeito as preferidas nos laboratórios de escola durante o período de formação dos estudantes de química do ensino médio.
Fontes:
THEODORE L. Brown, H. EUGENE LeMay, BRUCE E. Bursten. Química: A ciência central, São Paulo – SP: Editora Prentice-Hall, 2005. 9ª Edição. 992 págs.
https://web.archive.org/web/20121102191721/http://www.scribd.com/doc/3395764/Quimica-Aula-08-Reacoes-de-dupla-troca (acesso em 28/02/2010)
https://web.archive.org/web/20130723060129/http://www.scribd.com/doc/4489649/AULA-53-REACOES-DE-DUPLATROCA (acesso em 28/02/2010)
http://pt.wikipedia.org/wiki/Reação_de_dupla_troca (acesso em 28/02/2010)
Texto originalmente publicado em https://www.infoescola.com/quimica/reacao-de-dupla-troca/