Em 1811, o químico italiano Avogadro (1776-1856) realizou diversos estudos com gases, concluindo o que hoje conhecemos como Hipótese ou Lei de Avogadro:
"Volumes iguais, de gases diferentes, quando medidos à mesma temperatura e pressão, possuem o mesmo número de moléculas."
Na figura 1 está esquematizado este fato para a água e o dióxido de carbono, que com iguais volume, temperatura e pressão, ambos possuem o mesmo número de moléculas:
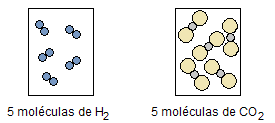
Figura 1. Volumes iguais, de gases diferentes, com mesma temperatura e pressão.
Quando o corpo está em seu estado gasoso, as moléculas tendem a se distanciar uma das outras, em constante movimento, o que faz com que as dimensões de cada molécula sejam desprezíveis se comparadas às grandes distâncias entre elas. Deste modo, o tipo de gás não influi no volume, que dependerá apenas do número de moléculas e das condições de temperatura e pressão.
A estas condições de temperatura e pressão convencionou-se chamar de CNTP (Condições Normais de Temperatura e Pressão). Até 1982, os valores padrões para temperatura e pressão eram:
T = 0ºC ou 273,15 K
p = 1 atm ou 101325 Pa
Mas a partir desta data, a IUPAC (União Internacional de Química Pura e Aplicada) alterou o valor da pressão, de forma que os valores padrões agora são os seguintes:
T = 0ºC ou 273,15 K
p = 100000 Pa ou 1 bar
O motivo da mudança no valor da pressão se deve, primeiramente, a alguns determinantes, como a simplificação dos cálculos, devido ao arredondamento para 105, a compatibilização com as unidades do S.I. (Sistema Internacional de Unidades) e as consequentes alterações nas tabelas de dados termodinâmicos, que não seriam grandes. Uma segunda motivação seria a dificuldade de se conseguir o valor exato de 1 atm, ao nível do mar. Quando se fala de medições ao nível do mar, é preciso levar em conta os diferentes níveis que existem na superfície terrestre, além das condições meteorológicas da região.
Com estas mudanças, o volume molar VM passou de 22,4 L/mol para 22,71 L/mol.
O Volume Molar de um gás é definido como o volume ocupado por 1 mol desse gás, sob determinada temperatura e pressão. Um mol sempre possui 6,02 . 1023 moléculas. Considerando a temperatura e a pressão nas CNTP, vamos ao cálculo do Volume Molar com o valor atual da pressão.
Pela Equação de Clapeyron,
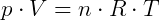
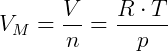
Tomando R = 8,3145J/(Kmol), T = 273,15 K e p = 100000 Pa, obtemos
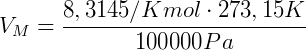
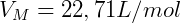
Este valor é o volume ocupado por um mol de um gás, nas CNTP, independentemente de sua natureza (tipo de gás).
Referências bibliográficas:
FELTRE, Ricardo. Fundamentos da Química, Volume Único – 1ª ed. – Moderna, 1990.
SILVA, Roberto Ribeiro da. Pressão, Temperatura e Volume Molar, 1995. Química Nova na Escola.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/condicoes-normais-de-temperatura-e-pressao-cntp/