Jacques Alexandre César Charles foi um cientista francês que notou um certo padrão na expansão de gases quando submetidos a um aumento de temperatura. Embora o estudo e formulação da lei tenham sido realizados por Gay-Lussac, Charles foi creditado por seu trabalho não publicado.
A Lei de Charles é aplicada para transformações gasosas onde a pressão é mantida constante. Portanto, a relação entre volume e temperatura é estabelecida por esta lei. O primeiro resultado importante desses estudos foi a descoberta que o coeficiente de expansão é aproximadamente o mesmo para diversos gases sob um mesmo intervalo de temperatura, podemos dizer hoje que esses gases são aqueles com comportamento próximo ao ideal. A relação entre a variação do volume e a variação de temperatura pode ser equacionada utilizando o coeficiente de expansão da seguinte forma:
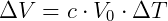
Onde 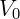 é o volume inicial do gás,
é o volume inicial do gás, 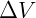 e
e 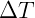 são respectivamente a variação do volume e temperatura e c é coeficiente de expansão cujo valor aceito hoje é
são respectivamente a variação do volume e temperatura e c é coeficiente de expansão cujo valor aceito hoje é 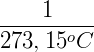 . A equação acima permite que, conhecendo o estado inicial de um gás possamos prever o estado final após transformações isobáricas.
. A equação acima permite que, conhecendo o estado inicial de um gás possamos prever o estado final após transformações isobáricas.
Embora a expressão acima seja uma forma útil de prever o comportamento de gases, a grande contribuição dessa descoberta foi a observação de que reduzindo a temperatura de um gás até um determinado ponto tornará seu volume nulo. A princípio isso foi interpretado como uma falha na lei, logo ela não valeria para temperaturas muito baixas, onde o volume seria reduzido a zero. No entanto, William Thomson, mais conhecido como Lord Kelvin, utilizou essa ideia para estabelecer uma escala de temperatura absoluta. Segundo Kelvin, existiria uma temperatura mínima que pode ser atingida, onde, sob um ponto de vista atual, o movimento das moléculas cessaria. Podemos demonstrar isso com a equação anterior da seguinte forma:
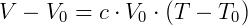
Utilizando a temperatura de 0 ºC como temperatura de referência temos:
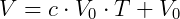
Fazendo V = 0:
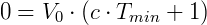
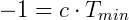
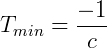
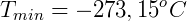
Desta forma Kelvin postulou o zero absoluto e propôs uma escala absoluta de temperatura, que hoje chamamos de escala Kevin, onde 0 K = -273,15 ºC e 273,15 K = 0 ºC.
Utilizar a temperatura na escala absoluta simplifica todas as expressões para gases, a Lei de Charles pode então ser escrita da seguinte forma:
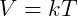
Onde k é uma constante de proporcionalidade e a temperatura T é dada em Kelvin. Alternativamente pode-se relacionar dois estados da seguinte forma:
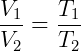
Que é uma forma conveniente para utilizar a lei de Charles no estudo de transformações à pressão constante.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/lei-de-charles/