Uma transformação isobárica ocorre quando a pressão do gás permanece constante, variando temperatura e volume. Suponhamos um recipiente de paredes rígidas com um gás perfeito em seu interior (Figura 1).
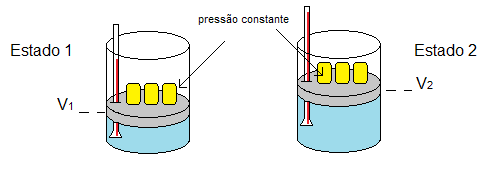
Figura 1: Aumento do volume e da temperatura em um gás perfeito. A pressão permanece constante.
Aquecendo o gás no Estado 1 por meio de uma chama, as moléculas se agitam pelo aumento da temperatura e, devido a sua alta energia cinética, empurram o pistão para cima fazendo aumentar o volume. Como os pesos sobre o pistão não mudam a configuração, ou seja, a pressão é constante, o volume tende a aumentar junto com o aumento da temperatura (Estado 2).
Este fato é conhecido por Lei de Gay-Lussac, enunciada da seguinte forma:
"Para uma dada massa de gás perfeito, mantida à pressão constante, o volume é diretamente proporcional à temperatura absoluta."
Podemos comprovar matematicamente por meio da equação dos gases perfeitos de Clapeyron,
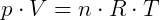
onde R é a constante universal dos gases perfeitos ou constante de Clapeyron, cujo valor nas condições normais de temperatura e pressão (CNTP) é R = 0,082 atm.L/mol.K.
Como R é constnate e no experimento o n (número de mols) e o P (pressão) também são, obtemos:
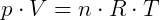
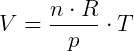
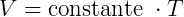
comprovando que o volume é diretamente proporcional à temperatura, com:

No gráfico temperatura x volume (T x V) verificamos a equação pela reta:
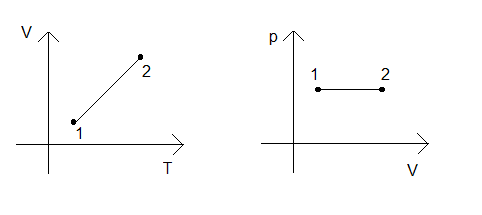
Já no gráfico volume x pressão (V x p), observamos que enquanto o volume aumenta do estado 1 para o estado 2, a pressão permanece a mesma.
Se neste tipo de transformação gasosa há um aumento do volume, dizemos que houve uma expansão isobárica. Se há uma diminuição do volume, dizemos que houve uma compressão isobárica.
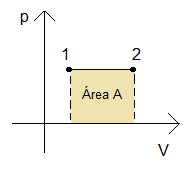
O trabalho no processo isobárico pode ser calculado pela área sob a curva no gráfico (V x p).
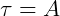
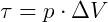
Texto originalmente publicado em https://www.infoescola.com/termodinamica/transformacao-isobarica/