O ácido pícrico, importante intermediário de várias sínteses dentro da química orgânica e de produtos naturais, apresenta fórmula molecular C6H2(OH)(NO2)3 e nomenclatura oficial IUPAC 2,4,6-trinitrofenol. Seu nome usual refere-se ao grego picros (amargo). Apresenta-se à pressão e temperatura ambientes como cristais amarelados. Era utilizado antigamente apenas como fins de coloração, hoje são conhecidas algumas de suas propriedades, que o faz ter aplicação desde a fabricação de explosivos até devido a seu feito anestésico para queimaduras. Entretanto, sua utilização tópica é motivo de debate, pois apresenta alta toxicidade, sendo “irritante para a pele, olhos e trato respiratório. A inalação pode causar danos aos pulmões. A exposição crônica pode causar danos hepáticos ou renais”1.
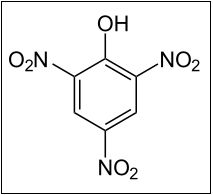
A estrutura molecular do ácido pícrico consiste em três grupos nitros ocupando as posições orto e para de um anel aromático, a partir de uma hidroxila, conforme pode ser observado abaixo. Vale lembrar que a hidroxila é um grupo orto-para dirigente, “ativando” a substituição nesses três carbonos específicos do anel, eu uma reação orgânica sob um mecanismo definido, conhecido por substituição eletrofílica.
O ácido pícrico é de grande importância, visto ser intermediário para a obtenção dos picratos de ferro e amônio. Sabe-se hoje que é um composto altamente explosivo, sendo extremamente sensível ao choque mecânico e ao aumento de temperatura; explode a aproximadamente 300°C, o que se deve aor grupos NO2 que apresenta.
O ácido pícrico pode ser obtido a partir da reação entre o fenol (C6H5OH) com ácido nítrico concentrado (HNO3) em presença de ácido sulfúrico concentrado (H2SO4), conforme procedimento experimental abaixo:
- Colocar em um frasco de erlenmeyer de 100mL uma ponta de espátula de fenol puro (aproximadamente 1g) e adicionar 1,5mL de H2SO4 concentrado. Agitar e levar a banho-maria fervente por 10 minutos. Após resfriar, adicionar 4mL de HNO3 concentrado e deixar na capela até que a reação comece a se processar, o que pode ser observado pela liberação de vapores nitrosos.
- Quando diminuir a intensidade da reação aquecer em banho-maria fervente por 30 minutos.
- Resfriar e adicionar 10mL de água gelada, deixando em banho de gelo até obter precipitação do ácido pícrico.
- Filtrar, lavando os cristais do ácido com porções de água gelada.
A identificação do ácido pícrico sintetizado pode ser feita mediante o procedimento descrito a seguir:
Em um copo de béquer de 100mL colocar 30mL de água destilada e uma pequena porção do precipitado. Nesta solução colocar um fio de lã branca natural. Ferver por alguns minutos. Esta será tingida, adquirindo a mesma coloração do ácido.
Referências:
1. http://pt.wikipedia.org/wiki/%C3%81cido_p%C3%ADcrico
http://www.zemoleza.com.br/carreiras/17368-sintese-do-acido-picrico.html
FELTRE, Ricardo, Química Geral, Vol. I, Ed. Moderna, 6° Ed., São Paulo/SP, 2004.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/acido-picrico/