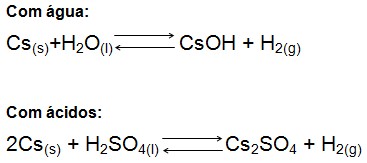O metal alcalino césio esta localizado na família 1A da classificação periódica dos elementos, possui símbolo Cs, ponto de fusão de 28°C, ponto de ebulição de 670°C, número atômico 55, massa atômica 132,9 u. É um dos poucos metais que se pode considerar que seja líquido a temperatura praticamente ambiente, sua configuração eletrônica está baseada no cerne e gás nobre xenônio [Xe] 6s1, apresenta uma coloração metálica amarelo claro levemente prateada, é um dos metais alcalinos de menor ocorrência.
 Sua descoberta ocorreu no ano de 1860, pelos cientistas Kirchoff e Bunsen, sendo o primeiro elemento a ser descoberto por espectroscopia, através da análise do espectro de água mineral, seu nome tem origem do latim “caesius”, que significa céu azul, em função tanto do metal quanto de seus compostos emitirem uma luminosidade de coloração azul. Em estado metálico deve ser armazenado em líquidos apolares ou gases inertes em virtude de sua alta reatividade. Reage com água violentamente produzindo CsOH, com liberação de hidrogênio e promovendo ataque ao vidro, motivo, pelo qual ele é usado na gravação deste.
Sua descoberta ocorreu no ano de 1860, pelos cientistas Kirchoff e Bunsen, sendo o primeiro elemento a ser descoberto por espectroscopia, através da análise do espectro de água mineral, seu nome tem origem do latim “caesius”, que significa céu azul, em função tanto do metal quanto de seus compostos emitirem uma luminosidade de coloração azul. Em estado metálico deve ser armazenado em líquidos apolares ou gases inertes em virtude de sua alta reatividade. Reage com água violentamente produzindo CsOH, com liberação de hidrogênio e promovendo ataque ao vidro, motivo, pelo qual ele é usado na gravação deste.
O césio quimicamente é um metal capaz de formar vários sais, reage violentamente e exotermicamente com ácidos concentrados e diluídos, com água, ainda serve como catalisador na hidrogenação catalítica na síntese orgânica.
Reações do césio:
É encontrado natureza nos minerais pollucite e lepidolita, e obtido a partir do resíduo da purificação do lítio, suas reservas estão localizadas principalmente no Canadá. É um metal extremamente tóxico e radioativo, emissor de raios alfa é utilizado em aparelhos de raio-X, capaz de transformar energia luminosa em energia elétrica, é componente de células fotovoltaicas. Outra importante utilização do césio é nos relógios atômicos que só atrasam 1 segundo a cada 60 milhões de anos, um deles é o NIST-F1, o qual marca o horário da América.
Vale apena lembrar, do maior acidente radioativo acontecido fora de uma usina nuclear, foi no Brasil no dia 13 de setembro 1987 com o isótopo 137Cs, no estado de Goiás quando o dono de um ferro velho desmontou um equipamento de em raios-X encontrado em um instituto de radioterapia destivado, e retirou de seu interior o CsCl, um sólido branco, que no escuro emitia uma luminosidade azul, em virtude da curiosidade das pessoas do local este composto espalhou-se, por vários locais provocando doenças e óbitos.
Leia mais:
Bibliografia:
http://www.daviddarling.info/encyclopedia/I/inorganic_chemistry_entries.html
http://www.chemicool.com/elements/caesium.html
http://images-of-elements.com/caesium.php
https://web.archive.org/web/20100402164846/http://www.fcf.usp.br:80/Ensino/Graduacao/Disciplinas/LinkAula/My-Files/acidente_radiologico-Goiania.htm
Russel, J. B. Química geral. São Paulo: Makron Books, 2004.
Mahan, B. M. Química: um curso universitário. 4a ed. São Paulo: Edgard Blücher, 2003.
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/cesio/