A passagem de um corpo ou uma substância do estado líquido para o sólido é chamada de solidificação. É importante deixar claro que esse nome se refere especificamente a esta transição de fases, pois mesmo que seja possível a formação de sólido por outro tipo de transição, como a passagem direta da fase gasosa para a sólida, este fenômeno recebe outro nome: ressublimação.
As figuras a seguir mostram partículas de um sólido, um líquido e um gás, respectivamente. Podemos ver que as partículas de um material sólido encontram-se menos agitadas, pois possuem menos energia cinética (temperatura menor), resultando em uma média de velocidade de movimento baixa.
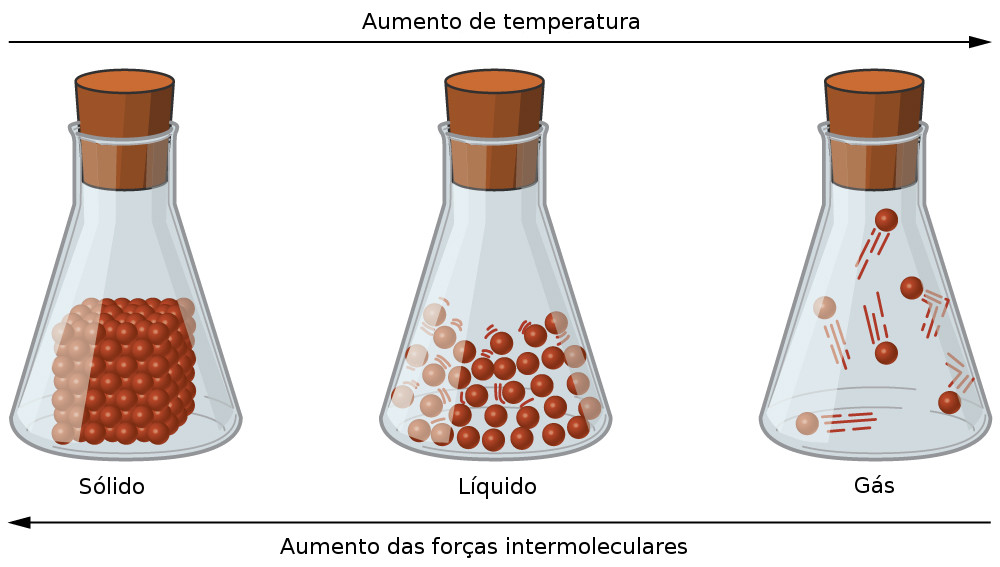
Estados físicos fundamentais da matéria. Ilustração: OpenStax College / CC-BY 4.0 / via CNX.org (adaptado)
Podemos interpretar a ilustração como a evolução dos níveis de agitação das partículas de uma substância, ou seja, quando as moléculas de um líquido começam a perder energia, seja por variações de pressão ou de temperatura, elas passam a se agitar cada vez menos e possuir menor liberdade de movimento, até chegarem ao ponto de não mais se caracterizarem como uma substância líquida, e começarem a se cristalizar, neste ponto dizemos ela se solidificou. (Obs: mesmo no estado sólido, as partículas apresentam certo grau de liberdade e estão em movimento, ainda que em menor intensidade).
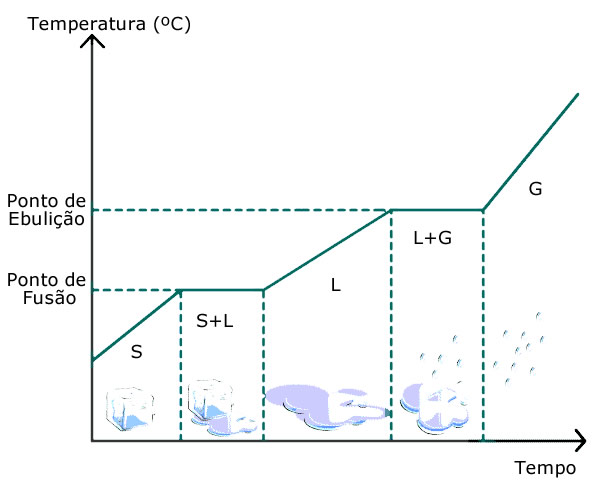
Ou seja, a solidificação é um processo exotérmico, isto é, libera (ou perde) energia em forma de calor, é por isso que para se formar gelo, é necessário que se resfrie a água. A temperatura na qual um corpo se solidifica é chamada de ponto de solidificação ou ponto de congelamento, que é a mesma do ponto de fusão, quando há passagem do estado sólido para o líquido. Neste momento de transição, a substância fica em equilíbrio dinâmico entre as duas fases, até que se solidifique totalmente.
Observe o diagrama de fases de uma substância pura. Note que a temperatura permanece a mesma durante o processo de solidificação ou fusão.
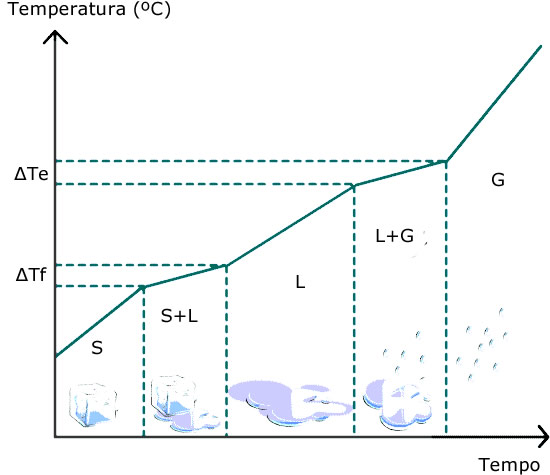
Já nas misturas, a energia se distribui entre aumentar a energia potencial e diminuir a energia cinética. Observando o diagrama genérico de solidificação:
No nosso cotidiano, o local em que mais presenciamos a solidificação é o congelador/freezer de nossas geladeiras, isto porque a água, tão abundante na Terra, se solidifica na pressão atmosférica de 1 atm em apenas 0 °C, uma temperatura facilmente alcançada por esses aparelhos.
Outras substâncias, no entanto, não se solidificam tão facilmente. O gás Hélio, por exemplo, precisa de uma pressão 20 vezes maior que a atmosférica normal e temperaturas muito extremas; já o Tungstênio continua sólido mesmo em temperaturas muito altas sob pressão normal e por isso filamentos deste material são usados em lâmpadas incandescentes, pois ao terem suas partículas aquecidas, os filamentos de tungstênio não gastam energia mudando de fase, em vez disso a emitem em forma de luz.
Em alguns materiais a cristalização ocorre de forma muito lenta e pode ser prolongada em certas condições. A indústria metalúrgica se utiliza desta propriedade de alguns metais numa técnica chamada de solidificação direcional, a qual possibilita a produção de componentes de diversos equipamentos que exigem uma liga metálica específica para sua estrutura. Neste processo, o material em estado líquido é passado por dentro de uma cavidade onde são controladas a temperatura e a transmissão de calor do conjunto. Simultaneamente, são feitas análises do material de forma a identificar impurezas, o teor percentual de cada tipo de metal para formação de ligas e o correto direcionamento da cristalização.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/solidificacao/