Sublimação é um processo físico de transformação direta da fase sólida para fase gasosa, sem passar pela fase líquida, que representa o nível intermediário de agitação das partículas.
Este processo ocorre em situações específicas de pressão e temperatura para certos materiais e pode ser explicado pela análise o seguinte gráfico:
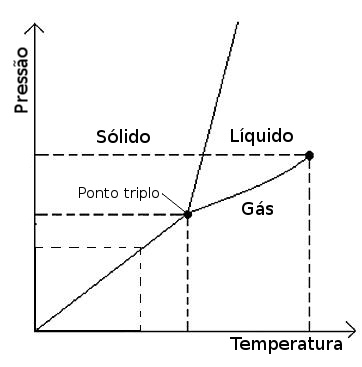
Este gráfico descreve, para um certo material, as transições de fases de acordo com a evolução da temperatura e pressão. Pode-se observar que existe um ponto no gráfico em que os três estados fundamentais (sólido, líquido e gasoso) coexistem em equilíbrio, o chamado ponto triplo. A pressão neste ponto é chamada de pressão de vapor, e é possível ver que sob pressões abaixo desta, um aumento de temperatura faz com que o material passe da fase sólida diretamente para fase de vapor. O mesmo efeito é observável quando, sob uma temperatura inferior à do ponto triplo, a pressão é elevada.
Para cada substância é possível construir um específico gráfico de Pressão versus Temperatura, de acordo com as suas propriedades físicas. Assim, enquanto alguns materiais precisam ser levados a condições muito extremas para sublimarem, outros podem sofrer tal fenômenos em temperatura ambiente.
As substâncias cuja sublimação ocorre muito facilmente possuem pressões de vapor muito altas. Como nos casos do dióxido de carbono (CO2), conhecido como gelo seco, e da naftalina (C10H8), em que a pressão de vapor é maior que a pressão atmosférica e por isso podemos vê-los sublimarem sob condições bastante suaves.

Gelo seco sublimando. Foto: Ratthaphong Ekariyasap / Shutterstock.com
A sublimação faz parte do princípio de funcionamento de importantes técnicas na indústria. Um deles é o preparo de alimentos desidratados, chamado de liofilização. Neste processo, o alimento cozido ou fresco é congelado, submetido a vácuo, ou seja, a pressões muito baixas, e então levemente aquecido de modo que todo gelo formado se transforme em vapor sem ter passado pela fase líquida. A comida é então selada em uma embalagem impermeável juntamente com oxigênio, o que permite que o material seja armazenado em temperatura ambiente, sem a necessidade de refrigeração por muito tempo.
A vantagem dessa técnica é que, como o gelo é sublimado, as temperaturas aplicadas são bem menores que em outros processos, danificando menos o tecido dos alimentos e mantendo inalterados os sabores e cheiros. Além disso o material desidratado dessa maneira pode ser reconstituído mais rapidamente, uma vez que seus poros, preenchidos por cristais durante o congelamento, foram mantidos. Este processo é utilizado em diversos setores de produção como na fabricação de comida para astronautas, leite em pó e outras bebidas solúveis e no armazenamento de produção de indústrias químicas e farmacêuticas.
Químicos também utilizam técnicas de sublimação para purificar compostos. Submetem sólidos à sublimação para que, ao serem transformados em gases, reste os resíduos, que foram deixados para trás, por possuírem propriedades diferentes do composto puro, que não possibilitaram sua sublimação. Esta técnica é aplicada quando níveis muito altos de pureza são exigidos, para satisfazer os consumidores.
Técnicas de sublimação também são utilizadas para imprimir imagens ou textos em objetos, como camisetas, canecas, etc. Neste processo, utiliza-se uma cera pigmentada, que é submetida a temperaturas próximas de 200 °C, o que lhe permite passar do estado sólido ao gasoso rapidamente e assim ser projetada no objeto onde se torna sólido novamente, resultando na impressão.
Leia também:
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/sublimacao/