Denominam-se fenômenos físicos as transformações que alteram os estados físicos da matéria. No ambiente observam-se três estados de agregação da matéria, também chamados estados físicos da matéria, dos quais podemos denominar: sólido, líquido e gasoso. São estes estados que sofrem alteração quando uma transformação física ocorre, em geral como resposta a alterações em condições presentes no ambiente.
A ocorrência de transformações físicas da matéria (sinônimo de fenômenos físicos) dá-se pela interação da matéria com grandezas físicas presentes no ambiente, em especial a energia. Embora existam diversas qualificações para o conceito de energia, é a energia térmica a principal responsável pelas transformações físicas que ocorrem nesta modalidade de transformação da matéria.
Deve-se observar, porém, que as transformações físicas da matéria são essencialmente diferentes das transformações químicas. As duas podem acontecer paralelamente com o mesmo material, mas ambas guardam profundas diferenças entre elas. Enquanto a transformação física altera principalmente o estado físico em que determinado material se encontra (sua aparência), a transformação química altera a composição interna deste material (sua essência química).
Para que se entenda melhor o conceito acima, serão analisados dois casos que podem ocorrer com a água, quando exposta a dois tipos de energia: a térmica e a elétrica.
A interação de uma molécula de água com corrente elétrica contínua, denominada eletrólise da água, transforma a água em dois produtos com propriedades físicas e químicas diferentes, conforme a equação a seguir:
Água ⇒ hidrogênio gasoso + oxigênio gasoso
H2O(ℓ) ⇒ H2(g) + O2(g)
Como ocorrera alteração na composição química, denomina-se este exemplo como transformação química.
Porém, quando em interação com a energia térmica, a água pode sofrer diversas transformações físicas, que acabam por alterar seu estado de agregação no ambiente. Por exemplo, ao retirar-se um cubo de gelo do congelador força-se o equilíbrio térmico entre o ambiente (com maior energia) e o cubo (com menor energia), e isto faz com que o cubo absorva energia térmica do ambiente. Este aumento de energia térmica aumenta a energia de cada molécula de água – que neste momento se encontram “presas” em um retículo cristalino – de tal maneira que, gradativamente, elas rompam a estrutura cristalina sólida e tornem-se um líquido amorfo.
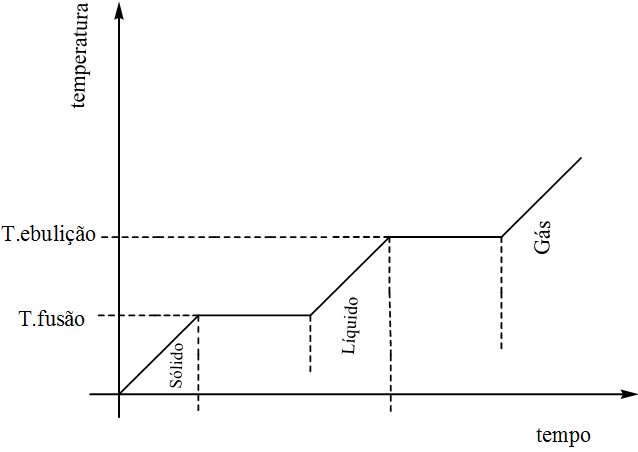
A esta transformação denomina-se fusão, que é a destruição da estrutura cristalina de um sólido e sua concomitante transformação em um líquido amorfo, em razão do aumento da energia térmica no sistema. A fusão não é instantânea e por este motivo o gelo demora a derreter por completo.
Note-se que a água não se transformou em outro composto químico, apenas modificou seu estado físico. A transformação física da água poderia ser assim descrita:
água sólida ⇒ (fusão) ⇒ água líquida ⇒ (ebulição) ⇒ água gasosa
H2O(s) ⇒ H2O(ℓ) ⇒ H2O(g)
Se fornecermos energia térmica (aquecer) a esta água, ela adquirirá energia suficiente para escapar à atmosfera na sua forma gasosa, o que caracteriza o fenômeno chamado ebulição. O processo contrário também ocorre, pois ao retirar-se energia (resfriar) do vapor de água, se obtém água líquida, e mantendo-se o resfriamento o resultado será a água sólida. À passagem direta, do estado sólido para o gasoso, chama-se sublimação, e o processo em sentido oposto, ressublimação.
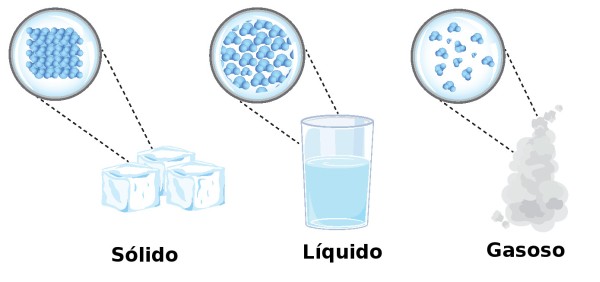
Os três estados da matéria. Ilustração: snapgalleria / Shutterstock.com [adaptado]
Leia também:
Referências bibliográficas:
LISBOA, J. C. F. Química, 1º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 42 – 49.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.23 – 27.
Texto originalmente publicado em https://www.infoescola.com/quimica/fenomenos-fisicos/