Os detergentes são substâncias químicas formadas por uma mistura de compostos orgânicos capazes de emulsionar óleos e manter a sujeira em suspensão. É um agente de limpeza que atua em diversas superfícies sem danificá-la.
Os tensoativos ou surfactantes, presentes nos detergentes, possuem propriedades essenciais para que ocorra a interação entre detergente, água e gordura. Foram desenvolvidos durante a Primeira e a Segunda Guerra Mundial, a partir do petróleo para suprir a falta de óleos animais e vegetais, muito utilizados para a produção de sabão. Desde então, o petróleo passou a ser uma substância estratégica para a fabricação de diversos materiais.
Atualmente, os tensoativos são produzidos de diversos produtos provenientes da petroquímica (derivados do petróleo) e da oleoquímica (derivados de lipídios). São elaborados para atuarem em diversas condições, sendo menos afetados que os sabões pelos minerais (sais de cálcio e magnésio) que promovem o aumento da dureza da água, característica importante para que ocorra uma limpeza satisfatória. São capazes de diminuir a tensão superficial da água possibilitando a interação.
Quimicamente os tensoativos apresentam na sua estrutura uma parte apolar (hidrofóbica) e uma parte polar (hidrofílica). A região apolar interage com óleos e gorduras, enquanto a região polar interage com a água. Esse mecanismo permite que o detergente forme micelas, e consequentemente, realize a limpeza.
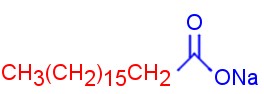
Estearato de sódio, um detergente. Observe a extremidade hidrofílica, em azul (polar), e hidrofóbica, em vermelho (apolar).
Para a sua produção são necessários hidrocarbonetos que irão constituir a parte hidrofóbica do tensoativo, e de outros compostos químicos como o ácido sulfúrico, o trióxido de enxofre e o óxido de etileno, que irão participar na formação da parte hidrofílica da molécula (extremidade amorfa). Alguns álcalis como hidróxido de sódio e hidróxido de potássio, também são utilizados na fabricação de tensoativos.
Os tensoativos podem ser aniônicos, catiônicos, anfóteros ou não iônicos. Esses tensoativos irão ser aplicados em cosméticos, shampoos, pasta de dente, géis, materiais de limpeza, entre outros. Os tensoativos aniônicos, como o dodecanoato de sódio, apresentam na sua estrutura hidrofílica grupamentos que em solução aquosa liberam íons carregados negativamente.
Os tensoativos catiônicos, em solução aquosa, liberam íons carregados positivamente. Um exemplo, são os sais de quaternário de amônio. Os tensoativos anfóteros, como o álcool amino fosfatidil, expressam as duas propriedades, isto é, a característica catiônica ou aniônica, que irá variar de acordo com o pH da solução. Já os não iônicos como o propilenoglicol, o polipropilenoglicol, a glicerina e o álcool dodecílico etoxilado, por apresentarem grupos oxigenados, realizam pontes de hidrogênio, reduzindo a disponibilidade da água para a sobrevivência dos micro-organismos.
Devido à sua ampla aplicação os detergentes são lançados no meio ambiente constantemente, participando da poluição dos rios e do solo. Os tensoativos são responsáveis pela espuma nos rios, afetando além das propriedades físico-químicas dos solos, os seres vivos que habitam nesse ecossistema, permanecendo no ambiente por longos períodos. Com isso, é de grande importância investir em materiais alternativos como os biodegradáveis, a fim de mitigar a sua contribuição para a degradação ambiental.
Referências
http://www.usp.br/massa/2014/qfl2453/pdf/Tensoativos-livrodeDecioDaltin-Capitulo1.pdf
https://cienciaetecnologias.com/tensoativos/
Texto originalmente publicado em https://www.infoescola.com/produtos-quimicos/detergentes/