Os compostos inorgânicos são aqueles que apresentam um metal ou hidrogênio ligado a um elemento ou a um grupo de elementos não-metálicos. As funções inorgânicas são: ácidos, bases, sais e óxidos. O ácido sulfúrico está dentro do grupo dos ácidos pois possui em sua estrutura hidrogênios ionizáveis e porque a única parte de carga positiva na molécula é o cátion H+.
Seu provável descobridor foi o alquimista medieval Jabir Ibn Hayyan e o nome do ácido sulfúrico inicialmente era Zayt al-Zaj, ou óleo de vitríolo. Este ácido possui a fórmula molecular H2SO4, sua geometria é tetraédrica e sua estrutura está representada abaixo:
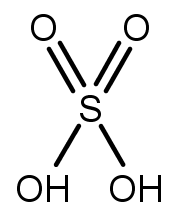
As ligações desta molécula são todas do tipo covalente polar.
A força dos ácidos está intimamente ligada à capacidade de formação de íons em água, acarretando consequentemente na condução de corrente elétrica. Uma das formas de analisar a força dos oxiácidos, que são os que apresentam oxigênio em sua estrutura é fazendo a subtração do número de hidrogênios ionizáveis do número de oxigênios presentes na molécula. Se o resultado for um número igual ou maior que 2 temos um ácido forte; se o resultado for igual a 1 o ácido é moderado e se for menor que 1 o consideramos fraco.
Por exemplo no caso do ácido sulfúrico temos a subtração:
(Número de átomos de O – Número de átomos de H)
(4-2=2)
Como o resultado é igual a dois podemos classificar o ácido sulfúrico como forte.
Algumas características dessa substância tão utilizada são: é líquido, incolor, extremamente tóxico e viscoso. Geralmente é comercializado com pureza de 97% e sua evaporação é bastante lenta na temperatura ambiente. Possui alto poder de corrosão e causa grandes problemas ao ser humano tanto quando ingerido acidentalmente, como quando inalado ou derramado sobre a pele. É obtido a partir de enxofre, oxigênio e água através de processo de contato (processo de oxidação catalisado por composto de vanádio ou platina).
As aplicações são diversas, pois este ácido é o mais utilizado na indústria e devido a isso ele serve como um medidor de índice industrial de um país, pois quanto mais há consumo desta substância, mais desenvolvida a indústria. O fator negativo desta grande utilização é o agravamento dos processos de chuva ácida devido a uma maior liberação de compostos de enxofre. Abaixo estão listadas algumas das suas aplicações:
- produção de ácido fosfórico;
- refinaria de petróleo;
- baterias automotivas;
- fabricação de fertilizantes transformando alguns componentes insolúveis em solúveis;
- fabricação de explosivos;
- fabricação de tintas e papel.
Texto originalmente publicado em https://www.infoescola.com/quimica/acido-sulfurico/