Em filmes, séries e desenhos quando são expostas as ações de ácidos, geralmente ocorrem exageros de todas as magnitudes. Retratam ácidos, como o sulfúrico, de maneira bastante agressiva e errônea, nos mostrando cenas onde o simples contato com tal ácido dissolve os tecidos da mão do protagonista que busca pegar uma chave submersa no ácido (filme de terror/suspense famoso). É muito claro que a ação dos ácidos é corrosiva e perigosa, mas o que se busca neste momento inicial é qualificá-la, desmistificando exageros clássicos que se apregoam há anos em nossa consciência coletiva.
Para qualificar a força de um ácido (em ácido forte, moderado ou fraco) é necessário esclarecer uma importante propriedade das substâncias iônicas: a ionização. E sobre este assunto debruçaram-se muitos químicos, em especial Svante August Arrhenius, que no século XIX propõe a teoria da dissociação iônica, afirmando ser iônica a natureza elétrica de muitos compostos. Esta teoria afirma que uma série de compostos, quando dissolvidos em um solvente (geralmente água), liberam espécies químicas carregadas eletricamente, denominadas eletrólitos. Tal fato permite a passagem da corrente elétrica na solução formada, que neste caso é chamada de solução eletrolítica. Há, no entanto compostos moleculares que não apresentam tal comportamento e por este motivo são denominados não-eletrólitos.
É a ionização, que ocorre com os ácidos em contato com a água e promove a liberação de seus íons. Este sistema aquoso passará a ter não somente as moléculas de água, mas também os íons do ácido e os compostos moleculares não ionizados do mesmo ácido. De maneira a compreender melhor esta informação, analisemos o exemplo a seguir:
O cloreto de hidrogênio (HCl(g)) é o gás que origina o ácido clorídrico (HCl(aq)). Isso ocorre em laboratório, por exemplo, ao se borbulhar o gás em água, pois a água ionizará a molécula do gás, conforme a equação:
HCl(g) + H2O(l) → H3O+(aq) + Cl-(aq)
São formados dois íons neste processo, o cátion hidroxônio (H3O+(aq)) e o ânion cloreto (Cl-(aq)). Porém, a ionização da molécula de cloreto de hidrogênio (HCl(g)) não é completa, pois para cada 100 moléculas dissolvidas em água, um total de 92 se ionizam. Restando, assim, oito moléculas dissolvidas e não ionizadas.
Este número (92 moléculas ionizadas) perfaz o que se convém denominar de grau de ionização do ácido clorídrico. E por se tratar de uma propriedade não exclusiva a este ácido somente, temos para o grau de ionização a seguinte expressão matemática: 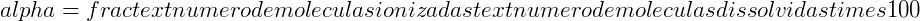 ;
;
O grau de ionização e consequente força de um ácido obedecem à seguinte relação:
| Grau de ionização (α) | Classificação em relação à força do ácido |
| α > 50% | Ácido forte |
| 5% < α < 50% | Ácido moderado |
| α < 5% | Ácido fraco |
Tabela 1. Correlação grau de ionização/força do ácido
Na tabela 1 é informada a força dos ácidos em relação à ionização dos mesmos. A tabela 2 apresenta ácidos clássicos e suas respectivas forças:
| Nome e fórmula do ácido | Grau de ionização (α) | Classificação quanto à força |
| Ácido clorídrico (HCl) | 92% | Forte |
| Ácido sulfúrico (H2SO4) | 61% | Forte |
| Ácido perclórico (HClO4) | 97% | Muito forte |
| Ácido nítrico (HNO3) | 92% | Forte |
| Ácido fosfórico (H3PO4) | 27% | Moderado |
| Ácido fluorídrico (HF) | 8% | Moderado |
| Ácido carbônico (H2CO3) | 1,3% | Fraco |
Leia também:
Referências bibliográficas:
LISBOA, J. C. F. Química, 2º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 206 – 208.
FELTRE, R. Físico – Química – 5ª Ed. – São Paulo: Moderna, 2000. p.304 – 325.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.234 – 242.
LISBOA, J. C. F. Química, 1º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 276 – 283.
Texto originalmente publicado em https://www.infoescola.com/quimica/acidos-fortes/