As forças de Van Der Waals recebem definições diferentes a depender do autor consultado: uns a conceituam como interações intermoleculares fracas (dipolo-dipolo – forças de Keesom, de orientação -, dipolo-dipolo induzido – forças de Debye, de indução -, e dipolo instantâneo – dipolo induzido – interações de dispersão ou forças de London; outros trazem esse termo como sinônimo de forças de London.
De qualquer forma, as abordagens a seguir serão úteis para ambos os casos.
Conteúdo deste artigo
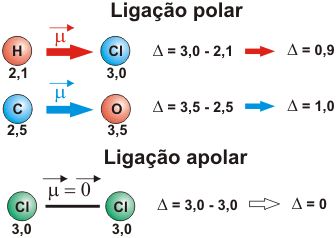
Momento de Dipolo
O vetor momento de dipolo de uma molécula é dado como o indicador da polaridade da mesma: semelhante a uma pilha (que apresenta dois pólos – negativo e positivo), uma molécula possui regiões onde a diferença de eletronegatividade entre átomos ligantes desloca a nuvem eletrônica para um deles. Isso significa que o par de elétrons compartilhado estará na maior parte do tempo ao redor do mais eletronegativo – na mecânica quântica, diz-se que a densidade de probabilidade de encontrar os elétrons encontra-se maior na região onde a nuvem é mais notável (ao redor do átomo com maior eletronegatividade).
Essas regiões podem ser caracterizadas por uma parte positiva (onde a nuvem eletrônica é menos densa) e uma negativa (onde é mais densa), assim, um vetor pode ser utilizado para representar a diferença de potencial entre esses dois pontos: o vetor nasce no pólo positivo e é direcionado para o negativo.
A molécula é dita polar quando a soma desses vetores produz um vetor resultante de módulo diferente de zero; o contrário vale para uma molécula apolar, onde a soma dos vetores de cada região (delimitada por dois átomos ligantes entre si) resulta num vetor cujo módulo é igual a zero.
Interações Intermoleculares
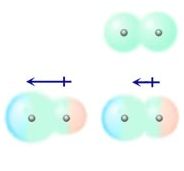
Dipolo-dipolo
Interações desse tipo são características de substâncias constituídas por moléculas polares, onde o pólo positivo de uma molécula liga-se com o pólo negativo de outra. Assim repetindo-se indefinidas vezes.
Dipolo-dipolo induzido
As interações dipolo permanente – dipolo induzido são observadas quando uma molécula polar deforma a nuvem eletrônica de uma molécula apolar. Assim, induz a formação de um dipolo.
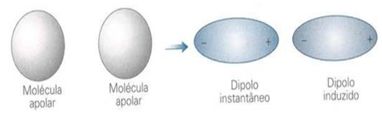
Dipolo instantâneo – dipolo induzido
Os elétrons que constituem a nuvem eletrônica de uma molécula estão em constante movimento, assim, se pudéssemos tirar fotografias dessa nuvem, elas não representariam a mesma imagem.
Ou seja, em moléculas apolares, há possibilidade de tornar-se polar durante um curto período de tempo. Entretanto, esse tempo é o bastante para que deforme a nuvem de outra molécula apolar e induza-a, de modo a formar dois pólos distintos (positivo e negativo). Tendo assim um dipolo induzido.
Verifica-se que a polarizabilidade de uma molécula apolar cresce com o seu tamanho, pois os elétrons da nuvem circundante encontram-se menos atraídos pelo núcleo. Por exemplo: o flúor se encontra no estado gasoso nas CNTP ao ponto que o iodo está no estado sólido.
Como a molécula de iodo é bem maior que a de flúor, é mais facilmente polarizável, assim, mesmo que as duas sejam apolares, as interações dipolo instantâneo – dipolo induzido são mais intensas na primeira substância.
Fontes:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
Texto originalmente publicado em https://www.infoescola.com/quimica/forcas-de-van-der-waals/