Em química a polaridade pode ser tratada a nível mais geral, como a polaridade de uma molécula ou mais especificamente por exemplo como tratamos da polaridade de uma ligação.
Para entendermos os conceitos a serem abordados neste artigo devemos primeiro entender o que significa a palavra eletronegatividade. Quando um átomo atrai um par eletrônico para si com mais “força” do que outro dizemos que ele é mais eletronegativo, portanto a eletronegatividade se baseia na tendência que determinado átomo possui em atrair elétrons compartilhados com outro átomo. Esta propriedade aumenta quando mais para a direita e para cima estiver o elemento na tabela periódica.
As ligações Químicas podem ser de três tipos: iônicas, covalentes ou metálicas. Neste caso iremos apenas tratar das duas primeiras. As ligações iônicas são aquelas as quais um metal se liga com um ametal, e neste caso as ligações entre os átomos são sempre polares. Porém quando falamos em ligação covalente podemos ter ligações polares e apolares ocorrendo entre os átomos envolvidos. Isto ocorre porque podemos ter ligados entre si átomos iguais ou diferentes. No caso da molécula do gás oxigênio (O2) temos uma ligação do tipo covalente apolar pois ambos os átomos exercem a mesma força de atração sobre o par eletrônico compartilhado fazendo com que essas forças se anulem e produzam uma ligação sem polos.
Quando tratamos da ligação entre os átomos do ácido clorídrico (HCl) percebemos que o Cloro possui uma maior tendência a atrair os elétrons do que o hidrogênio, e então formamos uma ligação do tipo covalente polar, sendo o polo positivo o hidrogênio e o polo negativo o cloro.
Simplificadamente pode-se dizer que ligações entre átomos iguais são apolares e entre átomos diferentes são polares.
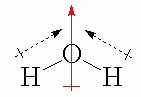
Quando trabalhamos com a polaridade da molécula devemos levar em conta sua geometria molecular, ou seja, o arranjo espacial da molécula. Neste caso devemos também conhecer o conceito de momento dipolar. A medida da polaridade das ligações é dada pelo momento de dipolo. Quando o momento dipolar é igual a zero temos uma molécula apolar e quando o momento dipolar é diferente de zero temos uma molécula polar.
Uma forma de avaliar se uma molécula é polar ou não é analisando o número de pares eletrônicos ligados ao redor do átomo central e o número de átomos iguais também ligados a ele. Quando esses números forem diferentes a molécula é polar e quando forem iguais a molécula será apolar.
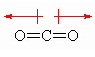
Outra forma seria através da miscibilidade entre as substâncias. Uma regra que devemos levar em conta é a que diz que semelhante dissolve semelhante. Ou seja, se uma substância é polar só poderá se dissolver em outra também polar e vice-versa. Por exemplo, sabendo que a água é polar e que o álcool é miscível na água podemos inferir que ele também é polar. Já a gasolina não é miscível em água então podemos dizer que a mesma é apolar.
Texto originalmente publicado em https://www.infoescola.com/quimica/polaridade/