A lei dos gases ideais ou gases perfeitos surgiu da combinação de leis que descrevem o comportamento de sistemas gasosos. A primeira dessas descrições é a Lei de Boyle, que pode ser expressa como:
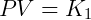
Onde fica estabelecido que o produto da pressão e volume é uma constante k1 que depende da temperatura. A segunda expressão importante é a Lei de Gay-Lussac, descrita abaixo:
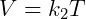
Essa lei diz que, dada uma certa pressão, o volume é proporcional a temperatura. Por fim temos a lei de Charles, que diz que pressão e temperatura são proporcionais, conforme a equação a seguir:
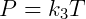
Essas três expressões podem ser combinadas de forma conveniente para escrever:
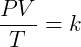
Onde k é uma constante. Essa relação indica que a razão do produto pressão-volume pela temperatura é constante. Essa constante é a mesma para todos gases ideais sob quaisquer condições, porém ela muda de acordo com a quantidade de matéria no sistema. Pela lei de Avogadro sabemos que:
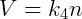
Onde n é a quantidade de matéria, normalmente medida em mols, de gás no sistema. Podemos então reescrever a relação anterior:
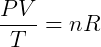
Onde R é uma constante universal para os gases ideais que independe de qualquer condição. Desta forma temos a expressão mais genérica, e útil para trabalhar com esse tipo de gás. Essa expressão é conhecida como Equação de Clapeyron, tendo sido formulada por Benoit Paul Émile Clapeyron pela combinação das leis dos gases conhecidas anteriormente. Usualmente escreve-se:
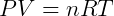
A constante dos gases R deve ser utilizada de acordo com as unidades de P, V e T. A tabela a seguir apresenta alguns valores da constante para diferentes unidades de pressão e volume.
| Pressão (P) | Volume (V) | Temperatura (T) | Constante (R) |
| Atm | L | K | 0,0820 atm.L.K-1.mol-1 |
| Pa | m³ | K | 8,314 Pa.m3.K-1.mol-1 |
| mmHg | L | K | 62,364 mmHg.L.K-1.mol-1 |
Quando um gás é submetido a uma transformação qualquer que não envolva alteração na quantidade de matéria podemos formular uma expressão relacionando o estado final e inicial do sistema:
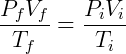
Essa relação é consistente com as leis de Boyle, Gay-Lussac e Charles.
É importante notar que as equações e leis descritas até agora são aplicáveis para gases ideais. Um gás ideal é idealizado como um conjunto de partículas (moléculas) se movendo constantemente de forma aleatória atendendo às seguintes condições:
- O volume ocupado por cada partícula é desprezível em relação ao espaço entre elas;
- Não existem forças interativas entre as partículas;
- As partículas interagem apenas através de colisões elásticas.
O modelo do gás ideal é muito útil e preciso para muitos gases, aqueles que não são bem descritos por este modelo são chamados de gases reais. Existe, porém, uma faixa de condições onde gases reais tem comportamento ideal, em geral essas condições envolvem baixas pressões e grandes volumes.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/lei-geral-dos-gases-perfeitos/