O hólmio é um elemento de transição interna pertencente ao grupo dos lantanídeos ou terras-raras. É um metal branco prateado brilhante, é relativamente macio, mole e flexível. A descoberta do hólmio iniciou-se através dos químicos suíços Delafontaine e Soret, quando eles observaram espectros diferentes na banda de absorção de outros metais, suspeitando assim tratar-se de um elemento “X”, que se encontrava na amostra que eles estavam analisando em 1978.
 Não obstante e de maneira independente o cientista sueco Cleve descobriu o metal durante sua pesquisa com a érbia, a comprovação de que realmente tratava-se de um novo elemento veio em 1911 quando Homberg preparou o óxido de hólmio, que é um composto amarelo intenso. O elemento recebeu este nome em homenagem a cidade de Cleve, Hólmia na Suécia, palavra latina de onde também deriva o nome Estocolmo, capital sueca.
Não obstante e de maneira independente o cientista sueco Cleve descobriu o metal durante sua pesquisa com a érbia, a comprovação de que realmente tratava-se de um novo elemento veio em 1911 quando Homberg preparou o óxido de hólmio, que é um composto amarelo intenso. O elemento recebeu este nome em homenagem a cidade de Cleve, Hólmia na Suécia, palavra latina de onde também deriva o nome Estocolmo, capital sueca.
Conteúdo deste artigo
Propriedades Físico-Químicas
- Símbolo Químico: Ho
- Número atômico: 67
- Peso Atômico: 164,93 g mol-1
- Ponto de Fusão: 1460 ° C
- Ponto de ebulição: 2720 ° C
- Densidade: 8,80 g cm-3
- Estado Físico a 25ºC: Sólido
- Nox: Ho+3
- Configuração eletrônica: 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d10 5p6 6s2 4f11
Quimicamente
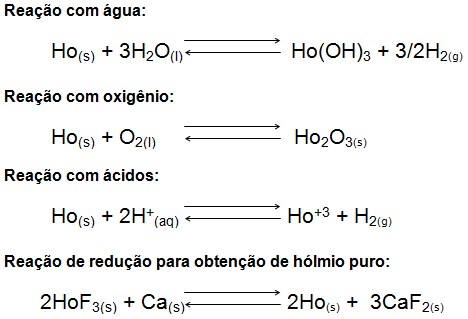
O hólmio é um metal relativamente estável quando exposto ao ar atmosférico, desde que o ar esteja seco e a temperatura a 25ºC. Quando o metal é exposto a temperaturas superiores a 1000ºC, ou ar úmido, observa-se a formação de uma película amarela em sua superfície de óxido de hólmio Ho2O3. O hólmio reage lentamente com ácidos minerais ou orgânicos que podem estar concentrados ou diluídos desprendendo hidrogênio e formando sais. O hólmio forma compostos como carbonato, acetato, nitrato, hidreto, óxido, hidróxido, oxalato, cloreto, fluoreto, iodeto e sulfato. As reações abaixo expressam melhor a formação dos compostos e obtenção do metal puro:
Obtenção, ocorrência e usos
O hólmio é obtido através da reação de redução do seu fluoreto com cálcio sob alta temperatura usando o tântalo como catalisador da reação com posterior purificação do metal através da fusão a vácuo, porém existem outros métodos de obtenção do metal tais como troca iônica e extração por solventes, como comumente tem acontecido no processo de purificação dos lantanídeos. Não existem pesquisas que apontam o grau de toxicidade do metal e nem de ação biológica, portanto o manuseio do hólmio deve ser cuidadoso em virtude de este pertencer a família dos lantanídeos que geralmente apresentam propriedades tóxicas.
O hólmio ocorre em minérios como cerite, gadolinita, na monazita onde está presente na proporção de 0,05% e é extraído comercialmente, xenonita e na euxenite, e comumente nos outros minerais em que são encontrados os demais lantanídeos, vale lembrar que assim como a maioria dos elementos químicos o hólmio não é encontrado na natureza em seu estado elementar. A utilização do hólmio é bastante peculiar, entre seus usos podem ser enunciados os seguintes:
- Os sais e outros compostos de hólmio são utilizados na fabricação de vidros especiais, cerâmicas, dopagem de granadas para fabricação de lasers, catalisadores na produção de combustíveis e sínteses orgânicas. A mistura entre compostos de fósforo, haletos metálicos e haletos de hólmio são utilizados na fabricação de lâmpadas especiais e tubos de televisores;
- O hólmio metálico é trabalhado em várias formas como chapas, discos, esferas entre outras formas. O metal é adicionado a ligas que suportam altas temperaturas, além de ser utilizado na fabricação de supercondutores em equipamentos que operam em altas temperaturas e no revestimento de reatores nucleares. O hólmio também é adicionado em ligas para fabricação de super imãs, em virtude de sua extraordinária característica de proporcionar campos magnéticos superiores aos existentes.
Bibliografia:
Jones, Loretta; Atkins, Peter Princípios de Química - Questionando a Vida Moderna e o Meio Ambiente - 3 ª Ed-Porto Alegre:Bookman, 2006
http://www.metall.com.cn/ho.htm
http://www.lanl.gov
http://www.images-of-elements.com
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/holmio/