A palavra termodinâmica tem origem nos termos gregos therme (calor) e dynamis (potência, força), sendo, desta forma, definida como o campo da física que estuda o calor em movimento (ou energia térmica em trânsito) e energia mecânica em movimento (trabalho). Ela trata dos fenômenos que envolvem os conceitos de calor e temperatura. Faz também o estudo das trocas de calor e de trabalho entre um sistema e o seu meio externo, das relações entre essas trocas e as propriedades do sistema.
Quando se fala em termodinâmica é necessário ressaltar as características dos estudos microscópico e macroscópico que podem ser feitos.
Ao estudar as leis da termodinâmica não convém fazer um estudo microscópico, pois envolveria um número gigantesco de partículas (da ordem de 1024), átomos ou moléculas, se movimentando de forma desordenada, colidindo entre si e com a parede do recipiente que as cercam.
Já a descrição macroscópica envolve poucos parâmetros e de fácil cálculo: volume, temperatura e pressão. O estudo das leis da termodinâmica faz, portanto, uma descrição macroscópica, sempre envolvendo um número grande de partículas (não faz sentido com poucas, como 2 ou 3), a fim de se fazer uma média dos muitos movimentos que acontecem no mundo microscópico, possuindo, assim, um caráter estatístico.
Sabemos, também, que as leis da termodinâmica surgiram como leis empíricas, com características fenomenológicas, e apenas mais tarde surgiram a mecânica e a termodinâmica estatísticas, oferecendo um estudo microscópico das leis.
Conteúdo deste artigo
Primeira Lei da Termodinâmica
A Primeira Lei da Termodinâmica trata do princípio de conservação da energia, de forma quantitativa. Num processo termodinâmico a energia total é conservada, de modo que a variação de energia interna (ΔU) de um sistema é a diferença entre o calor (Q) trocado com o meio e o trabalho (τ) realizado pelo sistema na vizinhança, por meio de uma força:
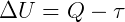
Em resumo, jamais um sistema pode criar ou destruir energia, apenas transformá-la.
Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica faz uma análise qualitativa do processo termodinâmico.
Ela tem dois enunciados, o de Clausius, concluindo que:
é impossível um sistema que apenas transfira calor de uma fonte fria para uma fonte quente ou só é possível o calor ir de uma fonte fria para uma fonte quente fornecendo energia ao sistema.
E o enunciado de Kelvin, que em resumo diz que:
em uma transformação cíclica é impossível transformar toda energia térmica (calor), recebida de uma unica fonte quente, em energia mecânica (trabalho).
Ou seja, o calor jamais fluirá de um corpo frio para um corpo quente, a não ser que haja trabalho. E nem todo calor será transformado em trabalho, uma parte é perdida, em uma máquina térmica funcionando em ciclos.
Ainda define-se a Segunda Lei constatando-se que a entropia só pode mudar em uma direção.
A entropia é uma propriedade do universo em que se mede o nível de irreversibilidade (desorganização) de um sistema. Quanto maior a entropia, maior a irreversibilidade. No zero absoluto não haveria desorganização.
A segunda lei comprova que a entropia do universo sempre aumenta e que nunca o zero absoluto poderá ser atingido.
Terceira Lei da Termodinâmica
A Terceira Lei da Termodinâmica define que, em uma escala absoluta de temperatura, cujo mínimo é o zero absoluto, no mínimo desta escala, a entropia de todas as substâncias é a mesma.
Lei Zero da Termodinâmica
A Lei Zero da Termodinâmica foi introduzida posteriormente às primeiras leis. Isto ocorreu devido ela ser concluída depois das primeiras leis, mas por ser fundamental para estas, foi chamada de Lei Zero, a fim de vir antes das demais.
Esta Lei define que, havendo dois sistemas que estão em equilíbrio térmico com um terceiro sistema, então estes dois sistemas estarão em equilíbrio térmico entre si. É o que acontece com o termômetro, por exemplo. Para saber se dois objetos tem a mesma temperatura, basta medir ambos com o termômetro. Havendo a mesma marcação, eles estarão em equilíbrio térmico entre si.
Lembrando que equilíbrio térmico é a igualdade de temperaturas.
Referência bibliográfica:
NUSSENZVEIG, Moysés, Curso de Física Básica: Fluidos, Oscilações e Ondas, Calor – Vol. 2, 4 ed. – Edgard Blücher, 2002.
Texto originalmente publicado em https://www.infoescola.com/fisica/leis-da-termodinamica/