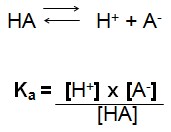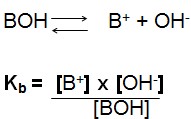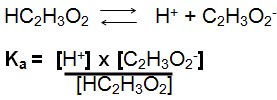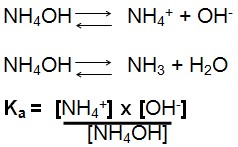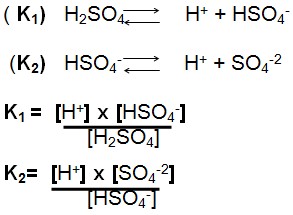A constante de ionização ou constante de dissociação pode ser definida como um valor que expressa a relação entre as concentrações dos eletrólitos dissociados em meio aquoso, ou mais precisamente aplicando a lei da ação das massas podemos afirmar que é o equilíbrio iônico em solução aquosa, de acordo com lei da ação das massas é também um equilíbrio químico onde a dissociação iônica é uma reação reversível.
Assim como as demais constantes de equilíbrio esta constante, nada mais é do que o quociente entre as concentrações dos íons em solução e a concentração do eletrólito.
Para o ácido genérico:
Observe que nesta reação de dissociação chamaremos de Ka a constante de ionização do H+ , quando temos um ácido forte a concentração do íon hidrogênio [H+] é elevada e portanto teremos um alto valor .
Para a base genérica:
Existe um parâmetro que podemos aplicar para definir a força de um ácido que é o grau de ionização (α) ou grau de equilíbrio iônico, que é o quociente entre a quantidade de um reagente que realmete reagiu até o equilíbrio ser atingido e a quantidade de mols do referido reagente. Portanto temos dois fatores que informam a força de um ácido, sendo estes o valor de sua Ka e seu α. Um cientista chamado Ostwald relacionou esses 2 parametros numa lei, a qual chamamos de Lei da Diluição de Ostwald.
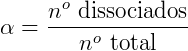
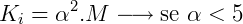
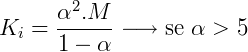
Onde:
- αé o grau de ionização
- Ki é a constante de ionização
- M é a concentração molar da solução.
É importante ainda salientar que 1 mol de um ácido ou de uma base durante a ionização libera um mol de cada íon como por exemplo.
- 1mol de HCl= 1mol de H+ e 1 mol de Cl-
- 1mol de H2SO4 = 2 mol de H+ e 1mol de SO4-2
- 1mol de NaOH= 1 mol de Na+ e 1mol de OH-
- 1mol de Ca(OH)2= 1 mol de Ca+ e 2 mol de OH-
Constante de ionização para o Ácido Acético:
Constante de ionização da base Hidróxido de Amônio:
Constante de ionização para um ácido diprótico:
Os estágios de ionização dos ácidos polipróticos ocorrem de acordo com o número de hidrogênios ionizáveis como, por exemplo, o ácido fosfórico, H3PO4 K1,K2 e K3, e assim sucessivamente.
Bibliografia:
Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .
QUÍMICA - UM CURSO UNIVERSITÁRIO / Mahan, Bruce M / Myers, Rollie J.- 2002 – 4° ed.
Texto originalmente publicado em https://www.infoescola.com/quimica/constante-de-ionizacao/