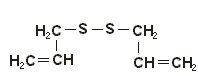Os Tiocompostos são substâncias cujas moléculas são formadas a partir da substituição do oxigênio, de moléculas anteriores, pelo enxofre. Ou seja, um ou mais átomos de enxofre deslocam um ou mais átomos de oxigênio por causa da semelhança de distribuição eletrônica (ambos possuem 6 elétrons de valência e se encontram na mesma família na tabela periódica).
Geralmente, os Tiocompostos são moléculas orgânicas e possuem baixa ocorrência na Natureza, sendo preciso sintetizá-los em laboratório para uso em escala maior.
Conteúdo deste artigo
Nomenclatura oficial dos Tiocompostos
| GRUPOS | DERIVAÇÃO | EXEMPLOS |
| TIOÁLCOOIS | Radical nº de carbonos +
Radical de saturação + Radical indicativo -otiol |
Et
na = Etanotiol otiol |
| TIOFENÓIS | Prefixo -Tio +
Sufixo fenol Ou Prefixo fenil+ Sufixo correspondente ao composto sulfurado |
Tio
Fenol = Tiofenol Fenil Hidrogenossulfato = Fenil-hidrogenossulfato |
| TIOÉTERES | Substituição do afixo –óxi por tio | Metóxi-metano
= Met-tio-metano |
| TIOÁCIDOS INORGÂNICOS | Acrescentar o prefixo tio antes do nome do ácido | Ácido sulfúrico
= Ácido Tiossulfúrico |
| DISSULFETOS ORGÂNICOS | Dissulfeto de + radical menor + radical maior
Ou Dissulfeto de + radical (caso exista apenas um radical na molécula) |
Dissulfeto de metil-propil
Dissulfeto de alila |
Exemplos
Meio de obtenção de tiocompostos orgânicos
Geralmente, a obtenção de Tioálcoois é obtida em reações que envolvem fornecimento de energia térmica. Considere R radicais alquila (Radicais derivados de um álcool orgânico) e R-X haletos de alquila (algum halogênio ligado a um radical alquila). Observe os exemplos:
1) 2KSH + R-SO4 -> R-SH + K2SO4
2) R-X + NaSH -> R-SH + NaX
A presença de metal alcalino nas reações é de grande importância, pois os compostos finais devem ser de grande afinidade. Caso contrário, a reação seria mais difícil de ocorrer.
A obtenção de sulfetos também envolve metais alcalinos, especialmente o Sódio pela sua grande reatividade com halogênios:
1) 2R-X + Na2S -> R-S-R + 2NaX
2) R-X + R-SNa -> R-S-R +NaX
Propriedades físicas e químicas
Praticamente todos os Tioálcoois são muito leves, voláteis e insolúveis em água. Possuem odor característico e são facilmente percebidos, mesmo em pequenas concentrações. São reativos a Mercúrio e outros metais de alta massa molecular, formando compostos cristalinos.
Os Tio éteres, por serem irritantes às mucosas, foram utilizados como gases tóxicos durante a Segunda Guerra Mundial, pois também apresentam alta volatilidade e ação sufocante. Hoje, não possuem ação comercial ou importância significativa.
Aplicações
O etanotiol é o Tioálcool mais utilizado, e sua aplicação maior é dada na síntese de sulfonal (utilizado na produção de medicamentos hipnóticos).
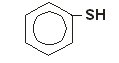
Dos Tiocompostos aromáticos (mercaptanas), o Tiofenol é o mais utilizado. Sua maior importância é na produção, por oxidação, de ácidos sulfínicos e sulfônicos (R-SO2H e R-SO3H, respectivamente). Assim como, é aplicado em mistura com outros gases que atravessam tubulações, para que pelo seu odor característico sejam detectados vazamentos.
Fontes:
SARDELLA, Antônio. Curso de química: Química geral, São Paulo – SP: Editora Ática, 2002. 25ª Edição, 2ª impressão. 448 págs.
https://web.archive.org/web/20100602062239/http://ube-167.pop.com.br:80/repositorio/4488/meusite/organica/tiocompostos.htm (acesso em 21/03/2010)
http://www.scribd.com/doc/7028079/11Tiocompostos (acesso em 21/03/2010)
Texto originalmente publicado em https://www.infoescola.com/quimica/tiocompostos/