Os métodos titulométricos ou titulometria são procedimentos quantitativos que se baseiam na medição de quantidade de um reagente que possui concentração conhecida e é consumido pelo analito (substância sendo analisada) até a completa reação do mesmo.
Conteúdo deste artigo
Titulometria volumétrica
Este procedimento analítico envolve a medida do volume de um reagente de concentração conhecida, chamada solução padrão ou titulante, que é consumido pelo analito, chamado de titulado. Sabemos que a reação chegou ao final quando há o que chamamos de ponto de viragem, ou ponto de equivalência, que corresponde ao ponto onde a quantidade de titulante adicionada equivale exatamente a quantidade de analito. Para realização deste procedimento, utiliza-se de vidrarias clássicas e simples de laboratório, como erlenmeyers, suportes universais e buretas.
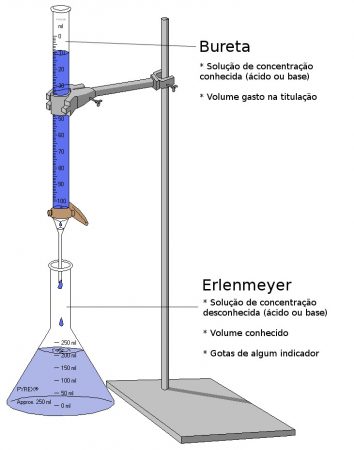
Aparato utilizado em titulometria volumétrica. Ilustração: Ivan Akira / via Wikimedia Commons / CC-BY-SA 3.0 (adaptado)
Utilizamos de indicadores visuais que causam alteração da cor da solução titulada quando ocorre o ponto de equivalência. Um dos indicadores mais utilizados é a fenolftaleína. Podemos utilizar também instrumentos específicos que respondam as alterações que ocorrem quando há a ocorrência da reação química, como turbidímetros, colorímetros, pHmetros, condutivímetros, entre outros.
A titulometria volumétrica pode ser divida em alguns tipos diferentes de métodos:
Titulometria volumétrica ácido – base
Também conhecida como acidimetria ou alcalimetria, neste método realiza-se a titulação de uma solução de ácido com um titulante básico (acidimetria) e realiza-se a titulação de uma solução básica com um titulante ácido (alcalimetria). O ponto de equivalência é visível com a utilização de indicadores ácido-base, como a fenolftaleína por exemplo, e torna-se visível através da mudança de pH do titulado.
Titulometria de complexação
Este tipo de titulometria baseia-se na formação de complexos solúveis. Normalmente utiliza-se o EDTA (Sal dissódico do ácido etilenodiaminotetracético) como reagente. Esta titulação é chamada de titulação complexométrica e é utilizada para realizar a titulação de quase todos os metais, e envolve a reação onde um íon metálico e um agente ligante (EDTA) formam um complexo suficientemente estável. Vejamos um esquema genérico da reação que ocorre, quando um íon metálico reagente com um ligante (EDTA) formando um complexo:
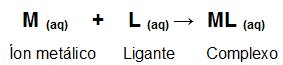
Os principais indicadores utilizados nas titulações de Complexação são o negro de eriocromo T, Camalgita, Arsenazo I, Alaranjado de Xilenol, Murexida e o Solocromo Azul Escuro.
Titulometria por precipitação
Este tipo de titulometria baseia-se na formação de compostos pouco solúveis. Normalmente utiliza-se soluções argentimétricas, como a solução padrão de nitrato de prata e uma solução de tiocianato de potássio ou amônio. Este tipo de titulometria pode ser utilizado desde que a reação se processe em velocidade adequada e possa se determinar o momento em que o ponto de equivalência for atingido.
Os principais indicadores utilizados nas titulações por precipitação são normalmente indicadores específicos, podem ser corantes orgânicos que possuam caráter ácido ou básico.
Titulometria por oxirredução
Este tipo de titulometria baseia-se na transferência de elétrons através de agentes oxidantes ou redutores. Normalmente utiliza-se soluções argentimétricas, como a solução padrão de nitrato de prata e uma solução de tiocianato de potássio ou amônio. Vejamos um esquema genérico da reação que ocorre:
![]()
Os métodos de titulometria por oxirredução recebem nomes específicos de acordo com a substância utilizada nas determinações, por exemplo, permanganometria, iodometria e iodimetria, entre outras.
Referências:
http://analiticaqmc.paginas.ufsc.br/files/2013/06/qmc5325-cap6-aula1.pdf
http://www2.dracena.unesp.br/graduacao/arquivos/quimica_geral/titulacao.pdf
http://www.ufjf.br/nupis/files/2011/08/aula-3-Introdu%C3%A7%C3%A3o-a-volumetria-QUI-094-2012.2-NUPIS.pdf
http://www.ufjf.br/baccan/files/2011/05/Aula_Pratica_10.pdf
http://www.ufjf.br/nupis/files/2011/04/aula-8-Volumetria-de-Oxiredu%C3%A7%C3%A3o-2011.1-NUPIS3.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/titulometria/