Com descoberta datada de 1836, o acetileno é o alcino mais importante, sendo a matéria-prima na síntese de muitos compostos orgânicos importantes, como ácido acético, plásticos e mesmo borrachas sintéticas. É um composto gasoso à temperatura ambiente, incolor, de odor agradável quando puro e parcialmente solúvel em água, diferente de outros alcinos, além de ser solúvel também em alguns solventes orgânicos polares como o álcool e o éter.
Possui temperatura de fusão e de ebulição muito próximas, na casa dos -84ºC e devido a seu alto poder de detonação costuma ser acondicionado dentro de cilindros metálicos de alta pressão em solução líquida de acetona. Tem alta reatividade como a maioria dos alcinos verdadeiros, sendo maior na presença de halogênios, oxigênio, cobre, mercúrio e prata.
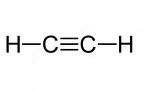
Fórmula estrutural plana do Acetileno.
Aplicações do acetileno
Antigamente o acetileno era utilizado em lanternas de carbureto para a exploração de cavernas. No entanto, por geralmente conter impurezas, possui um odor desagradável que pode causar dores de cabeça e dificuldades respiratórias. Seu uso foi descontinuado com o passar do tempo.
Este composto também é muito utilizado como combustível dentro de soldadores oxiacetilênicos (maçaricos) devido às altas temperaturas que a chama azul de sua queima é capaz de alcançar. A chama obtida pela queima do acetileno pode chegar a 3000 ºC e é usada para soldar e cortar metais de alta resistência térmica.
O acetileno também pode ser utilizado como matéria prima para a produção de fibras têxteis, borrachas sintéticas e polímeros. Dentre seu uso na produção de polímeros, podemos destacar:
- PVA (poliacetato de vinila) – usado na fabricação de cola e goma de mascar.
- PVC (policloreto de vinila) – usado em tubos hidráulicos, fraldas, couro sintético, bandejas, etc.
Ainda dentro dos usos industriais, pode ser utilizado na síntese de compostos orgânicos como ácido acético e álcool etílico e também na produção de explosivos devido a sua alta instabilidade e poder de combustão.
Por meio de processos ainda não muito conhecidos, o acetileno também age no amadurecimento artificial de frutas, porém com menor eficiência que o etileno.
Obtenção do acetileno
O acetileno pode ser preparado facilmente a partir da reação do carbureto com a água, num processo de duas etapas:
1ª etapa: Obtenção do carbureto a partir de calcário:
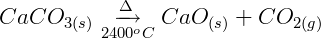
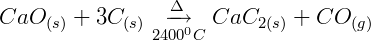
O calcário sofre aquecimento sob altas temperaturas para perder o gás carbônico de sua estrutura e formar a cal. A cal então reage com o carvão mineral (hulha) para gerar o carbureto.
2ª etapa: Produção do acetileno a partir de carbureto e água:
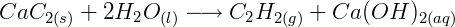
O carbureto reage com água líquida e sob temperaturas mais amenas, produz o acetileno e hidróxido de cálcio.
O acetileno por si só não é perigoso à saúde, mas devido a sua capacidade de diminuir o suprimento de oxigênio no meio, se inalado em quantidades altas pode causar perda de fôlego e dor de cabeça e, em concentrações acima de 40% pode levar ao colapso e perda de consciência.
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/acetileno/