Alcinos são hidrocarbonetos insaturados contendo uma ligação tripla (C≡C) e por serem hidrocarbonetos (constituídos apenas de carbono e hidrogênio), também são apolares. A sua tripla ligação configura alta instabilidade e por consequência, alta reatividade, principalmente em reações de adição.
Os alcinos são incolores e inodoros (sem cheiro), com exceção do acetileno que possui odor agradável. São insolúveis em água (exceção do acetileno que é parcialmente solúvel), porém apresentam certa solubilidade em solventes orgânicos polares como o álcool, o éter e outros. O etino, o propino (C3H4) e o butino (C4H6) são gases a temperatura ambiente, já os compostos do pentino até o C14H26 apresentam-se como líquidos e os alcinos superiores são sólidos.
Uma particularidade dos alcinos é o fato do carbono, quando em tripla ligação, comportar-se como um elemento mais eletronegativo do que carbonos de ligações simples ou duplas e por esta razão, o hidrogênio de alcinos terminais possui caráter ácido, diferentemente dos alcinos sem hidrogênio terminal. Alcinos que possuem este hidrogênio terminal são conhecidos como alcinos verdadeiros, enquanto os que não possuem, são chamados de alcinos falsos.
- Grupo Funcional: C, H.
- Nomenclatura: regra geral IUPAC + terminação -INO
- Fórmula Geral: CnH2n-2
Conteúdo deste artigo
Nomenclatura dos alcinos
Utiliza-se para os alcinos as mesmas regras de nomenclatura dos alcenos.
Exemplos:
| Etino (acetileno) | |
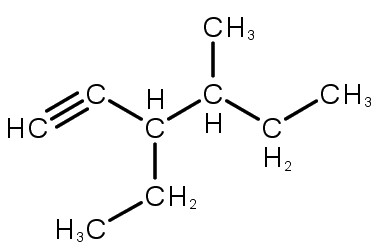 |
3-etil-4-metil-hex-1-ino |
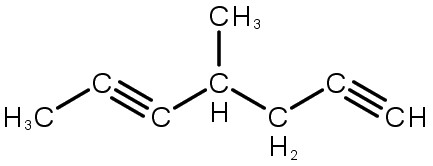 |
4-metil-hept-1,5-diino |
Quando houver mais de uma ligação tripla, a contagem da cadeia principal deve se iniciar na extremidade que dá a menor numeração para as insaturações.
Devido a tripla ligação, reação de adição de água a alcinos leva à obtenção de um álcool onde a hidroxila está ligada a um C=C de alceno que, devido a sua instabilidade, se converte rapidamente em um aldeído (no caso de alcinos verdadeiros) ou cetona (em alcinos falsos). Este processo é chamado de tautomeria. Alcinos verdadeiros são aqueles em que pelo menos uma ligação tripla ocorre com o primeiro ou último carbono da cadeia principal.
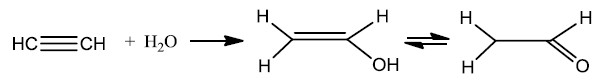
Obtenção de alcinos
Os alcinos são sintetizados em laboratório porque não se encontram livres na natureza, sendo uma das suas rotas sintéticas o craqueamento de alcanos derivados de petróleo. A obtenção de alcinos é mais complicada que a dos outros hidrocarbonetos, com exceção do acetileno (etino): HC≡CH, o alcino com maior aplicabilidade que se conhece até hoje.
O acetileno pode ser preparado facilmente a partir da reação do carbureto com a água, num processo de duas etapas:
1ª etapa: Obtenção do carbureto a partir de calcário:
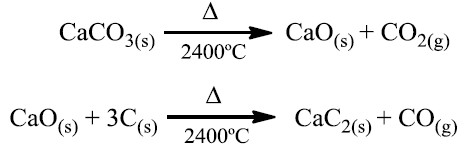
2ª etapa: Produção do acetileno a partir de carbureto e água:

O acetileno é o alcino mais importante, sendo a matéria-prima essencial na síntese de muitos compostos orgânicos importantes, como ácido acético, plásticos e mesmo borrachas sintéticas. Este composto também é muito utilizado como combustível dentro de soldadores devido às altas temperaturas alcançadas durante a sua queima. Por meio de processos ainda não muito conhecidos, o acetileno também age no amadurecimento artificial de frutas, porém com menor eficiência que o etileno.
Radicais dos Alcinos
Os radicais dos Alcinos são formados pela presença de um ou mais elétrons livres. Recebem a terminação -inil no lugar de –ino:
| Número de carbonos | Prefixo | Molécula | Radical | Nomenclatura |
| 1 | Met | - | - | - |
| 2 | Et | C2H2 | C2H | Etinil ou acetinil |
| 3 | Prop | C3H4 | C3H3 | Propinil |
| 4 | But | C4H6 | C4H5 | Butinil |
| 5 | Pent | C5H8 | C5H7 | Pentinil |
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica-organica/alcinos/