A formação de ligações químicas é um assunto importante na química, pois na maioria esmagadora dos casos, a natureza da ligação química altera diversas propriedades do composto formado. Compostos inorgânicos apresentam ligações duplas, caso do dióxido de carbono, CO2, e em conjunto com outros fatores altera a geometria molecular das substâncias.
A presença de ligação dupla na molécula ganha maior notoriedade e importância quando se estudam as moléculas orgânicas. É justamente nestas moléculas que os efeitos das duplas ligações são mais evidentes.
Na figura a seguir temos a representação de orbitais atômicos do carbono (sem hibridização).
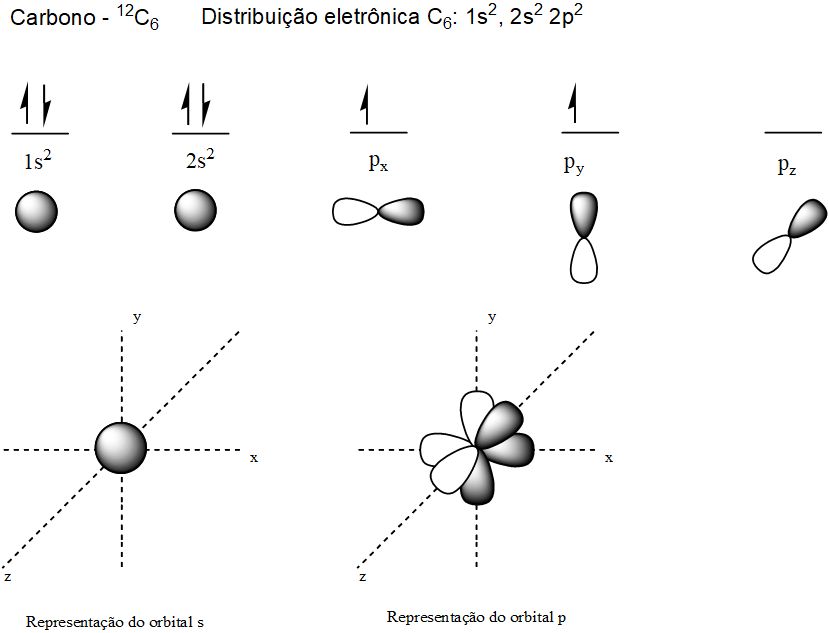
Orbitais atômicos possíveis do carbono.
Ligações entre os átomos de carbono são representadas normalmente com o modelo de bastão (H3C – CH3, por exemplo). Este modelo, no entanto, não é o mais adequado quando se procura explicar fenômenos inerentes a estas ligações, como a reatividade dos alcenos e alcinos.
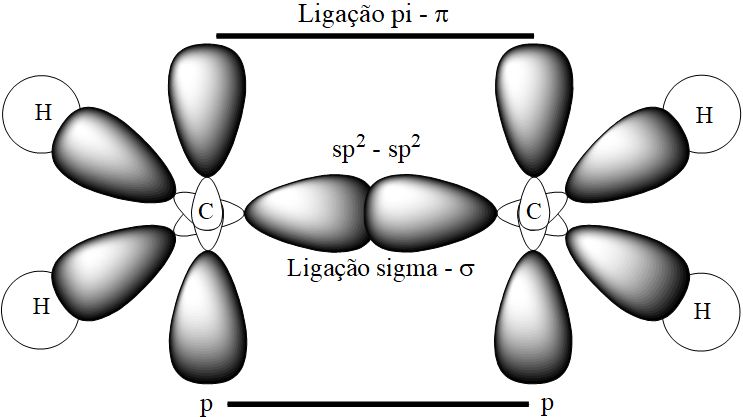
A reatividade destes compostos se dá devido à natureza da ligação química entre os carbonos. No caso da molécula de eteno (C2H4) temos duas ligações entre os carbonos, denominadas ligação σ (sigma) e ligação π (pi). No quadro a seguir tem-se a representação das ligações presentes na molécula de eteno (já hibridizadas – sp2):
Na molécula de eteno, a ligação σ (sigma) é formada pela superposição dos orbitais atômicos sp2. Esta ligação inicial é a mais forte, em comparação com a ligação π (pi). Já a ligação π é formada pela aproximação lateral dos orbitais p (em relação ao eixo), conforme se observa na figura acima.
Sendo uma ligação formada por orbitais atômicos que se aproximam em paralelo, esta ligação se torna mais frágil e pode ser rompida com menor aporte de energia. A figura abaixo demonstra a planificação da molécula de eteno, acentuando a projeção perpendicular do orbital “p”.
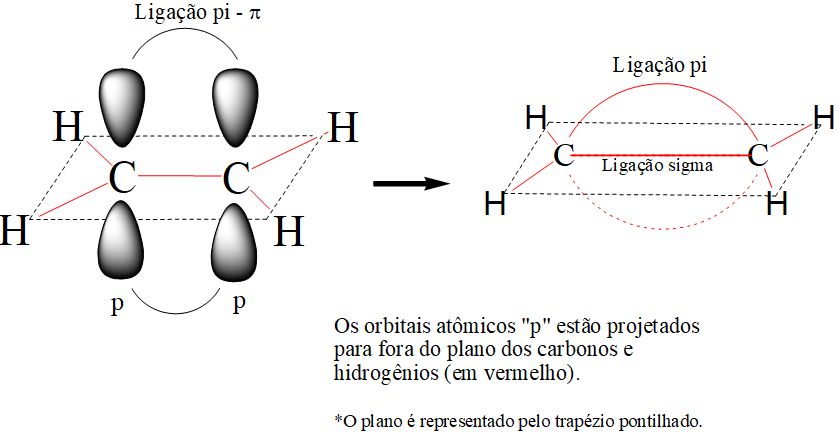
Orbital atômico “p”.
A ligação C – C, do tipo π, quando em dupla ligação, apresenta ≈ 63 kcal de energia, enquanto a ligação C – C do tipo σ apresenta ≈ 83 kcal. Isso justifica uma série de propriedades reativas que os alcenos apresentam, tais como a capacidade de participar de reações de adição, oxidação branda e oxidação energética, por exemplo. Reações de adição em alcenos podem ocorrer através de ataque eletrofílico ou ataque nucleofílico, e são utilizadas no setor produtivo em escala industrial. Diversos compostos são produzidos e a tabela a seguir traz um resumo básico dos processos e produtos correspondentes:
| Processo | Molécula reagente/catalisadora | Produtos |
| Adição de haleto de hidrogênio | HI, HBr, HCl, HF | Haletos orgânicos |
| Adição de halogênio | I2, Br2, Cl2,F2 | Haletos orgânicos |
| Adição de hidrogênio | H2/Ni ou Pt (catalisadores metálicos) | Alcanos |
| Adição de água | H2O | Álcoois |
| Oxidação branda | KMnO4(diluído) | Éteres, diálcoois (hidrólise) |
| Oxidação energética | KMnO4(conc)/H2SO4 | Cetonas, Ácidos carboxílicos |
| Ozonólise | O3 | Aldeído e cetona |
A presença de duplas ligações alteram questões ligadas aos ésteres naturais, como gorduras e óleos. Gorduras são ácidos graxos com longas cadeias saturadas e tendem a solidificar-se à temperatura ambiente, ao passo que óleos, por possuírem insaturações em suas cadeias, são líquidos à mesma temperatura.
Referências:
CAMPOS, M.M; AMARAL, L.F.P. [et.al]. Fundamentos de Química orgânica. São Paulo: Edgard Blücher, 1980. p. 75 – 109.
LISBOA, J. C. F. Química, 3º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p.58 – 59.
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-dupla/