Alcanos ou parafinas são hidrocarbonetos que possuem cadeia aberta e ligações simples (todos os carbonos são sp3). Como sua estrutura é composta apenas de carbono e hidrogênio em fazendo ligações do tipo C‒C ou C‒H, são apolares e por esta razão são insolúveis em água e solúveis em solventes apolares.
O termo parafina significa pouco reativa, do latim parum = pequena + affinis = afinidade, este nome vem de uma das principais características dos alcanos, que é a baixa reatividade quando comparados a outros compostos orgânicos.
Uma das principais aplicações dos alcanos é como solventes ou removedores de óleos e gorduras, no entanto essa propriedade os coloca em um grupo de substâncias perigosas ao meio ambiente, poluindo com facilidade rios, lagos, etc. Alguns dos removedores mais usados domesticamente são misturas de alcanos, como por exemplo a Aguarrás, o Faísca, etc.
Outro uso muito comum para os alcanos é como combustível. A energia liberada na queima desses compostos em presença de oxigênio é suficiente para mover motores a combustão, seja de uso doméstico (butano e propano), de uso automobilístico (GNV, gasolina, óleo diesel), ou de uso na aviação (querosene de aviação).
O petróleo é a maior fonte natural de alcanos pois estes já são encontrados em grande quantidade em sua composição, sendo necessária uma destilação fracionada para separá-los em fases. É importante ressaltar que nem todo petróleo possui a mesma composição. Alguns são mais ricos em hidrocarbonetos de cadeia aberta (alcanos), outros em misturas mais complexas de hidrocarbonetos. Em geral, o gás que existe nos poços de petróleo contém alcanos de cadeia carbônica pequena (metano, etano, propano, butano e isobutano).
Quimicamente, podemos caracterizar os alcanos da seguinte forma: os alcanos de cadeia normal de um a quatro carbonos são gases, de cinco a dezessete carbonos são líquidos e de dezoito carbonos em diante são sólidos. Os alcanos puros são incolores, os gasosos e os sólidos são inodoros e os líquidos têm cheiro característico (gasolina, por exemplo).
Grupo Funcional: C, H.
Nomenclatura: regra geral IUPAC + terminação ANO
Fórmula Geral: CnH2n+2
| Número de carbonos | Prefixo | Prefixo + Terminação ANO |
| 1 | Met | Metano |
| 2 | Et | Etano |
| 3 | Prop | Propano |
| 4 | But | Butano |
| 5 | Pent | Pentano |
| 6 | Hex | Hexano |
| 7 | Hept | Heptano |
| 8 | Oct | Octano |
| 9 | Non | Nonano |
| 10 | Dec | Decano |
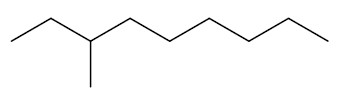
Estrutura de um Alcano
Quando houver ramificações na cadeia, essas devem ser escritas à frente da cadeia principal, utilizando a terminação –IL ou -ILA. A cadeia principal é contada a partir da extremidade mais próxima da ramificação. Exemplo:
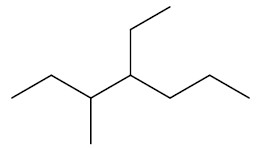
Se houver duas ramificações, nomeá-las sempre em ordem alfabética. Exemplo:
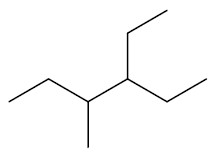
Quando houver dúvida, utilizar a contagem utilizar a contagem mais próxima da ramificação que virá primeiro em ordem alfabética. Exemplo:
Radicais de Alcanos
Os radicais dos alcanos são formados pela presença de um ou mais elétrons livres. Recebem a terminação -il ou -ila, no lugar de -ano. Exemplos:
| Número de carbonos | Prefixo | Molécula | Radical | Nomenclatura |
| 1 | Met | CH4 | CH3 | Metil ou Metila |
| 2 | Et | C2H6 | C2H5 | Etil ou Etila |
| 3 | Prop | C3H8 | C3H7 | Propil ou Propila |
| 4 | But | C4H10 | C4H9 | Butil ou Butila |
| 5 | Pent | C5H12 | C5H11 | Pentil ou Pentila |
Leia também:
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica-organica/alcanos/