Os glicídios se caracterizam por serem, juntamente com as proteínas e os lipídios, um dos maiores constituintes orgânicos de quase totalidade dos tecidos vivos, tanto vegetais como animais. Eles se destinam principalmente como fonte de energia para todos os organismos nos quais se encontram e, em muitos são também os principais componentes de suporte. No que tange aos vegetais, os glicídios se destacam por serem os compostos que se encontram em maior quantidade.
Cotidianamente chamados os glicídios de açúcares, ou ainda os conhecemos por carboidratos ou hidratos de carbono. Em sua estrutura química predominam as funções orgânicas aldeído e cetona.
Os experimentos que seguem tem por objetivo testar a solubilidade em água de alguns glicídios e identificar aqueles que apresentam propriedades redutoras daqueles que não apresentam, por meio da reação de Benedict.
Conceito: Os glicídios são derivados aldeídicos ou cetônicos de álcoois polihídricos. Compreendem demais aldeídos ou álcoois cetônicos (seus anidros ou polímeros).
a) Solubilidade: glicídios são compostos de alta polaridade, o que favorece a sua solubilidade em água, visto ser este solvente também polar.
- Tomar três tubos de ensaio e colocar em cada um deles uma pitada de glicose (glicídio) sólida.
- No tubo 1 adicionar 2mL de água destilada.
- No tubo 2 adicionar 2 mL de álcool etílico.
- No tubo 3 adicionar 3mL de acetona.
- Agitar os tubos e anotar solubilidade.
b) Reação de Benedict: diferenciação entre glicídios redutores e não redutores.
- Preparar 5 tubos de ensaio, marcá-los e pipetar para cada um 3mL do reagente de Benedict.
- Adicionar: no tubo 1: 5 gotas de glicose 1%; no tubo 2: 5 gotas de sacarose 1%; no tubo 3: 5 gotas de maltose 1%; no tubo 4: 5 gotas de amido 1% e no tubo 5: 5 gotas de água (serve para testar o reagente de Benedict, ou seja, é o tubo controle).
- Misturar bem e aquecer por três minutos em banho-maria fervente.
- Observar a cor e eventual formação de um precipitado.
Explicação:
No reativo de Benedict existe uma pequena porção de hidróxido cúprico com o cuprocitrato de sódio, sal complexo hidrossolúvel.
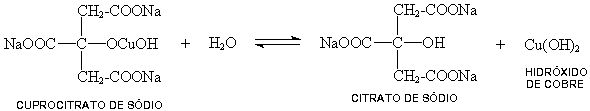
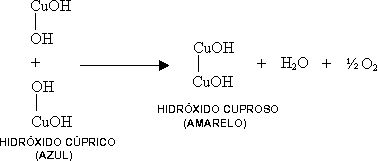
Sob a ação do calor e do álcali, o açúcar redutor se decompõe parcialmente em fragmentos oxidáveis, pelo hidróxido cúprico. Nesta reação o hidróxido cúprico (azul) se reduz a hidróxido cuproso (amarelo).
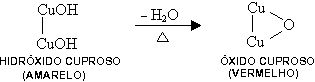
Continuando o aquecimento, o hidróxido cuproso perde uma molécula de água e transforma-se em óxido cuproso (vermelho).
Referências:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/glicidios-redutores-e-nao-redutores/