O homem tem buscado, ao longo da história, tornar-se capaz de compreender os fenômenos que regem a vida e o universo, utilizando como ferramentas principais a observação direta e a interpretação lógica daquilo que observa. Seu desejo então passa a ser o de submeter suas observações à experimentação, para que cada vez mais sinta-se localizado em seu ambiente. O elemento químico nitrogênio, em particular, merece destaque nesse ínterim, uma vez que está na base de todo organismo vivo, compondo o que chamamos de aminoácidos.
O nome desse elemento provém do grego e significa “formador de nitron”, onde “nitron” se refere ao nitrato de potássio, KNO3. Em francês, o nome para o nitrogênio é azoto, que significa “sem vida”. (O pioneiro químico francês A. L. Lavoisier observou que um rato morreu quando mantido em atmosfera de nitrogênio.) Os sais de amônio e os nitratos eram conhecidos dos primeiros alquimistas, que também prepararam o que deveria ser o ácido nítrico.1
O nitrogênio ocorre na terra como o principal constituinte do ar atmosférico, aproximadamente 78% em volume. Compostos inorgânicos do nitrogênio não são comumente encontrados como minerais, pois a maioria deles é solúvel em água. Em alguns locais de clima seco (ou que no passado tiveram clima seco) existem jazidas de nitratos, geralmente nitratos impuros de sódio ou potássio.
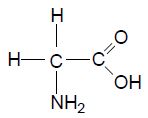 O nitrogênio é encontrado em compostos orgânicos em todos os seres viventes, animais e plantas. Proteínas, por exemplo, são moléculas gigantes, cujas peças constituintes são compostos contendo nitrogênio chamados aminoácidos.1,2 Um exemplo de um aminoácido simples é o ácido aminoacético, ou glicina, representado ao lado.
O nitrogênio é encontrado em compostos orgânicos em todos os seres viventes, animais e plantas. Proteínas, por exemplo, são moléculas gigantes, cujas peças constituintes são compostos contendo nitrogênio chamados aminoácidos.1,2 Um exemplo de um aminoácido simples é o ácido aminoacético, ou glicina, representado ao lado.
A fonte de nitrogênio combinado na matéria viva é, em última análise, a atmosfera, embora o gás nitrogênio (N2) não seja diretamente útil na síntese de proteínas. Uma das consequências das tempestades elétricas é, entretanto, a produção de pequenas quantidades de nitratos (NO3-) e nitritos (NO2-), que são arrastados para a terra pela chuva. Além disso, certas bactérias no solo e raízes de algumas plantas, especialmente os legumes, convertem o nitrogênio atmosférico em nitrogênio orgânico, que é então transformado por outras bactérias em nitrato, a forma de nitrogênio mais usada pelas plantas na síntese de proteínas, processo conhecido por “fixação”.
A diminuição do nitrogênio atmosférico é compensada pela produção de N2 por certas bactérias do solo e pela degradação de material protéico de plantas e animais. Existe uma interrelação complexa envolvendo o N2 da atmosfera, o NO3-, NO2- e o cátion amônio (NH4+) do solo e o nitrogênio orgânico das bactérias e organismos de grande porte. Essa relação, o ciclo do nitrogênio, mantém o conteúdo do nitrogênio atmosférico constante.
Referências:
1. MOORE, D. S. & ROBINSON, S. D.; Adv. Inorg. Chem. Radiochem, 30, 1-68, 1986.
2. ATKINS, P.; JONES, L.; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre, Bookman, 2001.
Texto originalmente publicado em https://www.infoescola.com/bioquimica/aminoacidos-e-nitrogenio/