Einstein propôs, em 1905, que a luz é quantizada em “pacotes”, aos quais deu o nome de quantum. A luz, uma onda composta por campos elétricos e magnéticos alternados, é também quantizada em uma unidade elementar, chamada fóton.
O conceito de um fóton não é claro, mas é possível descrevê-lo matematicamente em razões de suas propriedades. Um quantum de luz de frequência f tem uma energia E, dada por:
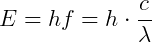
Em que h é a constante de Planck = 6,63 x 10-34 J.s = 4,14 x 10-15 eV.s, c = velocidade da luz e λ é o comprimento de onda.
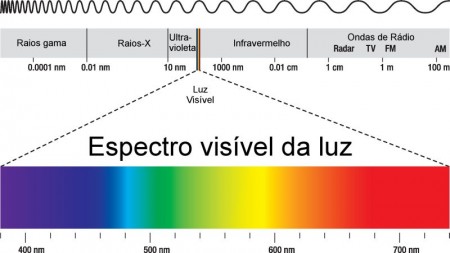
Portanto, a menor energia que uma onda luminosa pode ter é a de um único fóton: hf. Todas as energias que a luz possa ter são múltiplas de hf. O espectro eletromagnético da luz é composto então por fótons de diferentes comprimentos de onda, em que a luz visível abrange somente uma pequena faixa possível.
Em 1916, Einstein propôs que o fóton tenha momento 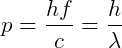 , portanto, sendo capaz de interagir com elétrons, por exemplo.
, portanto, sendo capaz de interagir com elétrons, por exemplo.
Afora toda a teoria quântica envolvida para descrição da estrutura dos átomos, e da matéria, portanto, não é errado pensar que os elétrons situem-se em torno do núcleo, tenham comportamento ondulatório, spin (momento) e estejam dispostos em níveis de energia também quantizados – a distribuição de Pauling é toda embasada neste fato.
Quando um fóton “colide” com um elétron, este poderá ser excitado a um nível de energia superior. Basta que o fóton seja suficientemente energético para isto. A física quântica nos permite, para cada elemento químico ou simplesmente material, determinar quanta energia é necessária para excitar o elétron da camada mais energética ocupada do átomo, a última. A este fenômeno também pode ser dado o nome de ionização.
Caso os fótons que interagem com a matéria excitam os elétrons das camadas de valências, alguns efeitos podem ocorrer, dentre eles a absorção, a reflexão ou a transmissão. A absorção ocorre quando o fóton cede toda a sua energia para elétron de valência, excitando-o. Quando isso ocorre e o elétron retorna à camada de valência, há a emissão de um fóton de igual energia ao incidente. Ou seja, reflexão. Se o fóton não interagir com a matéria, haverá o fenômeno de transmissão.
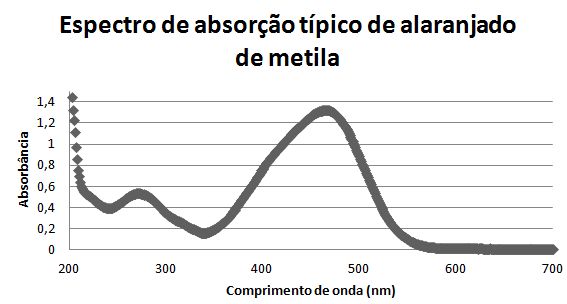
Assim, a absorção de luz é uma forma de caracterização de materiais. Uma solução, por exemplo, tem sua cor definida pela luz transmitida. Uma solução de alaranjado de metila, tem seu espectro de absorção demonstrado no gráfico abaixo.
Olhando o espectro, não é difícil descobrir porque a cor emitida pela solução é alaranjada. A partir do valor de energia correspondente aos fótons de 600 nm (amarelo/laranja, conforme figura 1), não há absorção de luz.
Este princípio da interação fóton-matéria, com alteração ou não para estados excitados, é o mecanismo dominante na absorção de luz. Os aparelhos que trabalham especificamente com a medição destes valores de absorbância são os espectrofotômetros, vastamente utilizados com uma série de técnicas de caracterização de materiais.
Bibliografia:
Halliday, David - Fundamentos de Física 4: óptica e física moderna. Halliday, Resnick, Walker. 8a edição. LTC, 2009.
Tipler, Física Moderna. Terceira edição. LTC.
Dados do acervo de pesquisas do autor.
Texto originalmente publicado em https://www.infoescola.com/fisica/absorcao-de-luz/